Mosquitos transgénicos para combatir la epidemia de dengue
Brasil libera millones de insectos modificados genéticamente para combatir la enfermedad Los animales producen larvas incapaces de llegar a la fase adulta

Dos son las necesidades básicas de todo animal: saciar el hambre y reproducirse. Si lo primero está en la base de los picotazos que las hembras del mosquito Aedes aegypti propinan a los humanos para obtener su sangre —proceso durante el cual le inoculan el virus del dengue—, lo segundo es la base de la última de las soluciones que se ensayan para frenar la enfermedad.
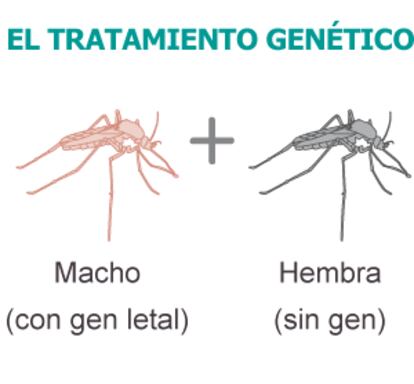
Después de algunos intentos a menor escala, Brasil lidera la idea: se trata de soltar machos modificados genéticamente para tener crías no viables. Con eso, sacian el afán reproductor de la hembra, y se espera reducir la población de insectos. En esta línea, la ciudad de Juazeiro, en el interior del Estado de Bahía, se ha convertido en el primer laboratorio en el que las autoridades sanitarias han asumido el reto de reducir la incidencia del dengue a través de la liberación de millones de mosquitos transgénicos. Allí se inauguró el 7 de julio la primera biofábrica de la Organización Social Moscamed, donde se crían semanalmente medio millón de Aedes aegypti genéticamente modificados. En la misma ciudad, perdida en el campo del noreste brasileño y conocida por ser donde nació el legendario maestro de la bossa nova, Joao Gilberto, investigadores de Moscamed han soltado cada semana miles de insectos con el objetivo de frenar el avance de una de las epidemias que más preocupan anualmente al Gobierno.
El primer ensayo se desarrolló en un barrio de Juazeiro donde el dengue golpea fuerte y, según los científicos de Moscamed, se ha conseguido reducir la población de mosquitos en un 85 %. “Percibimos que los mosquitos transgénicos se comportan igual que nos que los que no han sido genéticamente modificados. Viven unos 20 días y no salen de un radio de vuelo máximo de 80 o 100 metros”, explica Danilo Carvalho, gerente del proyecto. El Gobierno de Bahía ha invertido 1,6 millones de reales (640.000 euros) en la fábrica de Juazeiro. Los Aedes transgénicos ya habían sido empleados en menor escala en las islas Caimán y Malasia.
Aunque aún falta por probar la relación entre la disminución de la población de Aedes y la caída de los casos de dengue, los científicos de Moscamed han anunciado que en breve se iniciará un segundo ensayo. “Ahora pretendemos llevar la experiencia a la localidad de Jacobina, de 79.000 habitantes”, confirma Carvalho, “y después podríamos pensar en una ciudad como Campinas (en el Estado de São Paulo), antes de plantearnos llevar el proyecto a una gran ciudad”. La idea es potenciar la cría de Aedes hasta tener cuatro millones de mosquitos semanales, adelanta Moscamed.
Según el investigador, existen evidencias de que es necesario liberar 500 mosquitos transgénicos semanales por habitante para garantizar una disminución de la población de Aedes.
Si funciona, la idea —según sus promotores— tiene un gran futuro. Porque, de hecho, la infección por virus del dengue está en aumento. Los datos de la Organización Mundial de la Salud (OMS) indican que 2.500 millones de personas viven expuestas a ella. Cada año, la contraen entre 50 y 100 millones, de las que unas 500.000 necesitan ser hospitalizadas. De ellas, aproximadamente el 2,5% (unas 12.500 personas), muere.
El dengue es un virus viajero. Se ha aprovechado perfectamente bien de las posibilidades ofrecidas por el ser humano. Si en los años setenta del siglo pasado solo había una decena de países con brotes, ahora se ha extendido desde África a Sudamérica y el sureste asiático. Bueno, lo ha hecho el mosquito, que ha llevado con él el virus. Y es que el insecto es resistente y tiene pocos requisitos: clima cálido y húmedo, y un poco de agua estancada para poner en ella sus huevos. Les basta el resto que queda en un plato bajo una maceta, la que se acumula en el interior de un neumático viejo, un pequeño charco o una lata. Y si están sucios, con materia orgánica para alimentar a las larvas, mejor: a los 10 días se tendrá una nueva generación de mosquitos dispuestos a transmitir el dengue y otras enfermedades.
El virus hemorrágico causa unas 12.500 muertes al año
Esta adaptabilidad de los insectos ha hecho fracasar todos los intentos de controlarlos. Ni los insecticidas ni las mosquiteras o la desecación de zonas húmedas ha conseguido reducirlos. Así que solo queda atacarles en lo que más les duele: su reproducción.
La idea de crear mosquitos estériles para combatir plagas no es nueva. Pero sí lo es el método de conseguirlos. Podría decirse que lo que usa Brasil, con la asesoría de la descubridora de la tecnología, la británica Oxitec, son machos estériles, pero solo a medias. Porque se trata de animales capaces de reproducirse, y lo suficientemente vigorosos como para seducir a las hembras. Pero que tras esa fachada esconden su incapacidad para producir una generación viable de animales. Podría decirse que son estériles diferidos.
El proceso para conseguirlo es ingenioso y muy laborioso. De una manera resumida, se trata de obtener mosquitos machos que transmitan a sus huevos un gen que haga que el insecto no sobreviva a la fase larvaria. De esta manera, se engaña a las hembras, que si no quedaran preñadas tras el encuentro con el macho buscarían otro. Así se rompe el ciclo biológico del insecto.
La idea no es nueva. Desde los años cincuenta se ha intentado reducir los mosquitos soltando machos estériles, pero lo que fallaba era el método. Para conseguirlo, se irradiaba a los animales. Pero con ello se los debilitaba, y las hembras los rechazaban porque prefieren machos vigorosos para procrear.
Solo se modifican los machos, que no son los que pican
La diferencia es que ahora los ejemplares que se sueltan son, al menos de aspecto, tan robustos como los demás. La clave del proceso es que los huevos lleven el gen que hará que las larvas no sobrevivan en un entorno natural. Pero sí en uno controlado. Ése es el truco.
¿Cómo se hace? La respuesta está en que, en el laboratorio, donde se crían, los mosquitos reciben una cantidad de un antibiótico común, la tetraciclina. Con ello, de alguna manera todavía no muy explicada, se compensa el efecto de la modificación genética.
Cuando los machos se liberan en un entorno natural (por llamar así a los barrios de las ciudades), no disponen de ese antibiótico. Así que los machos fecundan a las hembras, les transmiten el gen, las mosquitas ponen los huevos, estos eclosionan y las larvas mueren. La idea es reducir poco a poco la población de insectos, hasta conseguir que no queden animales para transmitir el dengue u otras enfermedades, como la malaria.
El director ejecutivo de Oxitec, Hadyn Parry, rebate por correo electrónico las pegas puestas por EL PAÍS a este proceso, que implica nada más y nada menos que liberar animales modificados genéticamente. En Brasil, donde las pruebas son a gran escala, “trabajamos con quienes conocen el terreno, como Moscamed y la Universidad de São Paulo”. “En segundo lugar, siempre lo hacemos dentro de un sistema regulador para que haya supervisión local”, añade.
Los ecologistas creen que hay que investigar más antes de la suelta
Además, Parry recalca que no hay peligro por la liberación de nuevos genes al medio ambiente. “Solo hay dos efectos de la suelta de mosquitos: o se aparean con una hembra, y sus descendientes no sobreviven, o no lo hacen, pero en ambos casos mueren a los pocos días. Como son estériles, el gen no se propaga, y no se cruzan con otras especies”.
Lógicamente, la idea ha causado recelos. Incluso en Brasil, donde los cultivos transgénicos están muy asentados (es el tercer productor del mundo). Uno de los miedos que señalan los ecologistas es que no se sabe qué pasará si uno de estos animales modificados pica a un ser humano. Parry también tiene respuesta para esto: “Modificamos machos que no pican; eso lo hacen las hembras”. Otro posible riesgo es qué pasará si los mosquitos son comidos por otros animales, y entran así en la cadena trófica.
Camilo Rodríguez Beltrán, investigador de la Universidad del Desarrollo de Chile, dice que es necesario completar todas las pruebas antes de aplicarla en campo. “El problema es que la estrategia tiene un bache: hay una cantidad de mosquitos que van a sobrevivir”, dice en conversación con BBC Mundo. “Varios de los insectos genéticamente modificados van a permanecer en la naturaleza, y algunos serán hembras que transmiten el dengue”, añade. Habría, entonces, una nueva población de Aedes modificados sin presencia previa en los ecosistemas. Hasta ahora se desconoce el impacto que tendrían en el entorno.
Pero los promotores del ensayo creen que los riesgos son minúsculos comparados con sus beneficios. “El objetivo no es otro que matar el mosquito, ya que es la única manera de frenar el virus del dengue. Los humanos podemos transportar los huevos del Aedes y no existen vacunas para prevenir el virus”, insiste Carvalho.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.




























































