Descubierta la clave para “educar” a las células del corazón
La medicina regenerativa busca superar las limitaciones de la medicina actual y conseguir que el músculo cardíaco afectado pueda repararse
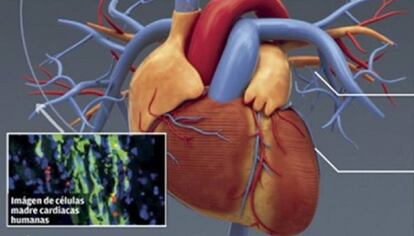
Las enfermedades cardiovasculares son la primera causa de muerte en todo el mundo. Cada año, entre 17 y 18 millones de personas mueren debido a ellas. Entre estas enfermedades, el infarto al corazón es una de las principales preocupaciones de la salud pública. Por sí sola causa alrededor de 9.5 millones de muertes anuales, el 11 % del total de muertes en el mundo.
El infarto cardíaco se produce por una falta de aporte de nutrientes y oxígeno a las células cardíacas. En la absoluta mayoría de los casos, se debe al bloqueo de los vasos sanguíneos que nutren al corazón (las arterias coronarias) por depósitos de grasa (arteriosclerosis) y coágulos de sangre (trombosis). Como consecuencia, las células cardíacas, especialmente las musculares (llamadas cardiomiocitos), mueren "asfixiadas" tras varios minutos sin recibir aporte sanguíneo. Así, el tejido cardíaco muerto no solo es incapaz de latir, sino que se convierte, poco a poco, en una cicatriz que puede interferir con la funcionalidad global del corazón hasta provocar un fallo cardíaco y la muerte.
Desafortunadamente, los actuales tratamientos médicos poco pueden hacer por el tejido cardíaco una vez que ha muerto. Tan solo se pueden paliar los síntomas e intentar retrasar que este tejido sea todavía más perjudicial para el corazón. En realidad, solo hay un tratamiento realmente curativo: el trasplante cardíaco. Sin embargo, existe un gran desequilibrio entre los donantes y los solicitantes de tan preciado órgano. Sencillamente, no hay corazones para todos y es un problema que irá a más con el envejecimiento progresivo de las poblaciones occidentales.
La medicina regenerativa busca, precisamente, superar las limitaciones de la medicina actual. Se trata de conseguir que ese músculo cardíaco afectado pueda repararse o regenerarse. En definitiva, que el corazón vuelva a funcionar con normalidad o, al menos, funcionar mejor que tras el infarto. Para ello, entre las principales herramientas de la medicina regenerativa encontramos a las células madre.
Células madre
En la actualidad, es muy sencillo extraer células adultas (maduras) de un paciente y, mediante un cóctel específico de genes, reprogramarlas para convertirlas a células madre. Tras este proceso, éstas cuentan con la capacidad para diferenciarse en casi cualquier tipo de célula (de la piel, del hígado, de los vasos sanguíneos...). Son las llamadas células madre pluripotentes inducidas (iPS). Sus descubridores recibieron el Premio Nobel por esta revolución para la biología pero, también, por las grandes posibilidades que se abrían para la medicina regenerativa.
Ahora mismo, sabemos muy bien como "domar" las células para que pasen de adultas y maduras a células madre, inmaduras. El gran reto se presenta al intentar lo contrario: conseguir que esas células madre inmaduras puedan transformarse en cardiomiocitos adultos. Hasta ahora, las diferentes estrategias empleadas en este campo experimental han tenido un éxito parcial. Solo han conseguido que las células madre se transformasen en células cardíacas, pero en una etapa inmadura.
Implantar células inmaduras en el corazón de una persona adulta provocaría la descoordinación y varios problemas médicos, entre ellos arritmias. Sería como meter a niños de parvulario en la universidad, un descontrol total
Sin embargo, para que, en un futuro, se puedan tratar a las personas afectadas por un infarto cardíaco, es vital que los cardiomiocitos que se implanten sean adultos. ¿La razón? Nuestros cardiomiocitos (adultos) funcionan de forma muy diferente de aquellos inmaduros procedentes de las células madre. Las células cardíacas inmaduras son más pequeñas, su contracción es más débil, laten espontáneamente, su metabolismo es distinto, conducen la actividad eléctrica de forma diferente... Implantar estas células en el corazón de una persona adulta provocaría la descoordinación entre las células adultas y las inmaduras, provocando varios problemas médicos, entre ellos arritmias. Sería como meter a niños de parvulario en la universidad, un descontrol total.
Hace apenas una semana, investigadores del departamento de Cardiología del Hospital Infantil de Boston han conseguido entender la clave para conseguir "educar" a las células cardíacas inmaduras para que maduren hasta adultas. Sus hallazgos se han publicado en la revista Nature Communications y suponen un importante paso adelante para la medicina regenerativa cardíaca. El descubrimiento se ha dado gracias a una revolucionaria y novedosa herramienta de modificación genética: CRISPR/Cas9. Otro hito de la ciencia.
La revolucionaria y novedosa herramienta de modificación genética CRISPR/Cas9 es otro hito de la ciencia
El enfoque de los científicos ha sido muy ingenioso y elaborado. Con este preciso corta y pega genético, lograron modificar genéticamente y de forma selectiva a uno de cada diez cardiomiocitos de ratones recién nacidos para eliminar un gen particular. El motivo por el que no modificaron genéticamente a todos los cardiomiocitos es sencilla: al interferir con procesos vitales del corazón, provocarían una alteración de su función y la muerte de los animales. Al eliminar genes concretos (probaron hasta 10 diferentes) en una pequeña población de cardiomiocitos del corazón, se aseguraban de que los ratones siguieran viviendo y el corazón funcionara con relativa normalidad. Al mismo tiempo, podían comparar las diferencias en la maduración de los cardiomiocitos normales con respecto a aquellos modificados genéticamente.
Al eliminar un gen en particular, el factor de respuesta al suero (SRF), en los cardiomiocitos de los ratones recién nacidos, se observó que estas células eran incapaces de madurar. Mientras el resto de cardiomiocitos maduraba e iban adquiriendo las típicas características de las adultas, las células modificadas genéticas permanecían igual, eternamente inmaduras como si padecieran la versión celular del síndrome de Peter Pan.
En otras palabras, la función del gen SRF es clave para "educar" y hacer madurar a los cardiomiocitos. Con este conocimiento en mente, los próximos pasos científicos están muy claros. Investigadores de diferentes partes del mundo van a probar a modular la actividad del SRF y así educar a los cardiomiocitos inmaduros procedentes de células madre humanas para que maduren, de una vez para siempre. Aún falta por ver si este gen, SRF desempeña exactamente el mismo papel en células humanas. Aunque lo más probable es que sí. Además, parece que no será, en principio, tan sencillo usar este gen como varita mágica educadora ya que si funciona demasiado tampoco produce la ansiada maduración de los cardiomiocitos. Será necesario entender los intrincados procesos celulares que hay detrás para manejar SRF correctamente.
En definitiva, gracias al descubrimiento de la función del gen SRF como clave para la "educación" de los cardiomiocitos para que maduren a adultos, la medicina regenerativa cardíaca ha derribado una de sus principales barreras. Es algo para celebrar, los científicos en este campo llevan más de 10 años intentando educar, sin éxito, a los cardiomiocitos para que madurasen. La irremediable rebeldía de estas inmaduras células parece que ha llegado a su fin.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.




























































