Virus que se vuelven antivirus
Diseñado un método rompedor contra la resistencia a los antibióticos Está basado en fagos, unos virus que atacan a las bacterias

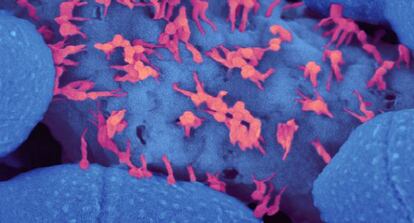
El abuso de los antibióticos, y hasta su mero uso reglamentario en los hospitales, están generando una epidemia de bacterias resistentes a esos mismos fármacos vitales. La Big pharma se emplea a fondo para desarrollar nuevos antibióticos que maten a las bacterias resistentes a todos los anteriores, pero esa es una carrera muy difícil de ganar, porque la naturaleza no solo es más sabia, sino también más rápida que los farmacólogos. Una idea rompedora se abre camino: utilizar fagos (virus bacteriófagos, o que atacan a las bacterias) contra los microbios que han aprendido a chulear a nuestros fármacos. Si no puedes vencer al enemigo…
Únete a él, a la naturaleza misma, que ya diseñó hace miles de millones de años los sistemas más eficaces, controlados y versátiles para doblegar a las bacterias: los fagos. Udi Qimron y su equipo de la Facultad de Medicina de la Universidad de Tel Aviv han diseñado un método basado en fagos capaz de devolver a las bacterias resistentes a su antigua condición de sensibles a los antibióticos, y que además destruye selectivamente a los gérmenes que no responden al fármaco. Presentan la prueba de concepto en la publicación científica PNAS.
El sistema es capaz de devolver a las bacterias resistentes a su antigua condición de sensibles a los antibióticos, y que además destruye selectivamente a los gérmenes que no responden al fármaco
La idea de usar fagos contra las bacterias no es exactamente una novedad. La firma GangaGen, fundada por el científico indio Janakiraman Ramachandran, lleva más de una década investigando en fagos con objetivos médicos (http://www.gangagen.com/phage.html). Aunque la firma tiene la sede en California, su nombre hacer referencia al río Ganges de la India natal de Ramachandran, donde resulta obvio que las bacterias abundan, pero también los virus que las infectan. Ley de vida. Los fagos, en realidad, son las estrellas absolutas de la vida en la Tierra, y su gran reservorio de variedad –y variabilidad— genética.
Incluso el descubridor de los fagos, el médico y microbiólogo canadiense Félix d’Herelle (1873-1949), ya reparó en los albores del siglo XX en la gran promesa antibacteriana que suponían los virus que acababa de descubrir. No llegó a tener éxito, pero tampoco a fracasar: fue solo la penicilina del doctor Fleming, tan accesible y eficaz, la que mandó la línea de investigación de D’Herelle al cajón de los vagos recuerdos. Hasta ahora que la penicilina y su estirpe farmacológica están empezando a patinar, o al menos a pedir refuerzos.
Qimron y sus colegas israelíes han utilizado uno de los virus bacteriófagos más estudiados del siglo XX, el fago lambda, a cuyo cóctel endemoniado de complejidad genética, éxito biológico y miniaturización física –auténtica nanotecnología natural— se debe enfrentar todo estudiante de ciencias de la vida de este planeta. Lambda, con unos 50 genes, es un especialista en infectar a la bacteria más común de nuestro intestino, Escherichia coli, y ha sido un fiel aliado de los biólogos moleculares desde hace medio siglo.
El descubridor de los fagos, el médico y microbiólogo canadiense Félix d’Herelle (1873-1949), ya reparó en los albores del siglo XX en la gran promesa antibacteriana que suponían los virus que acababa de descubrir
Los detalles de la técnica son enrevesados, pero aquí están para entretener a los aficionados a los crucigramas: las bacterias resistentes a los antibióticos reciben fagos modificados (con la rabiosa técnica de edición genómica crispr-cas) para atacar a los genes que confieren la resistencia (genes de la beta-lactamasa, una enzima que rompe la penicilina y sus derivados). Uno de estos fagos integra su genoma en la bacteria y coexiste con ella, el otro la mata para reproducirse lo más posible. El resultado final es que la población de bacterias resistentes se vuelve sensible a los antibióticos. Pura lógica evolutiva, si uno logra ponerse en el lugar de un fago.
Los investigadores de Tel Aviv no pretenden por el momento aplicar sus descubrimientos al tratamiento de pacientes, pero sí a la esterilización de los quirófanos y demás dependencias hospitalarias, que es donde se genera buena parte de las bacterias resistentes. Su sistema de fagos, proponen, puede usarse para tratar las superficies expuestas y como componente de los jabones de manos que utilizan los cirujanos. Creen que ello podría yugular la generación de resistencias en su mismísimo cocedero, que son los hospitales donde se juntan los portadores de todas las bacterias peligrosas que existen bajo el sol, y todos los antibióticos que ha imaginado la industria en el último siglo.
El gobierno soviético contrató a D’Herelle el siglo pasado para coordinar varios laboratorios dedicados a los fagos. Pero ya ven, Oriente Próximo se les ha adelantado en el siglo XXI. Por algo será.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.




























































