Manipulan los genes del parásito de la malaria para lograr una vacuna
Los científicos lograron activar el sistema inmune usando ejemplares debilitados del patógeno

La manipulación genética promete crear una nueva vacuna contra la malaria. Investigadores de EE UU han cambiado tres genes al parásito que la provoca logrando una población de ejemplares debilitados. Infectaron con ellos a mosquitos que picaron a una decena de voluntarios. Ninguno desarrolló la enfermedad pero todos activaron su sistema inmunitario contra el patógeno.
La malaria es la enfermedad infecciosa que más mata cada año en el mundo, en especial a niños. Unos 300.000 pequeños de menos de cinco años murieron en 2015. A pesar de las mosquiteras, de los insecticidas, de las medicinas, de los millones dedicados a su lucha por filántropos como Bill Gates, ese año había 214 millones de infectados, según la Organización Mundial de la Salud (OMS). Solo el coste de controlar la enfermedad superó los 2.400 millones de euros en 2014.
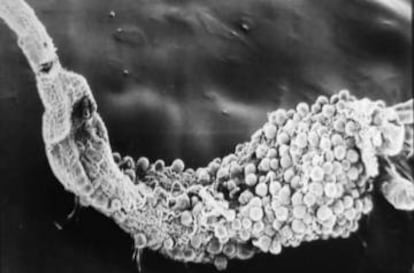
Pero para vencer a la malaria falta el arma definitiva: una vacuna que inmunice a la población expuesta. El problema es que el Plasmodium falciparum, la especie de protozoo que causa la variante más dañina de la enfermedad es un bicho difícil de combatir. A pesar de su tamaño microscópico, es varios órdenes de magnitud más complejo que los virus, tradicionales objetivos de las vacunas, o las bacterias. Además, su ciclo vital, usando de huésped a mosquitos y a humanos en distintas etapas, complica aún más el diseño de una vacuna eficaz. La que más lejos ha llegado es la RTS,S, desarrollada por GSK y con participación de investigadores españoles del ISGlobal.
La malaria es la enfermedad infecciosa que más mata cada año en el mundo, en especial a niños
Ahora, un grupo de investigadores de EE UU ha combinado una de las tradiciones más antiguas de la historia de las vacunas con las modernas herramientas genéticas para lograr una vacuna que, en sus primeros ensayos, se ha mostrado segura, logrando un porcentaje elevado de protección y de forma duradera. Buscaban atenuar la virulencia del parásito para que, sin provocar la malaria, indujera una respuesta del sistema inmune. Así, cuando un mosquito con Plasmodium no modificados picara a un humano, sus defensas rechazarían el ataque. Enfoques como este hay varios entre las más de 60 candidatas a vacunas de las que tiene constancia la OMS. Lo diferente en este caso es que esta vez, han debilitado el protozoo es su propia base, en su genética.
"Identificamos genes que el parásito necesita para desarrollarse dentro de las células del hígado", dice el director de la división de ciencia traslacional del Centro de Investigación de Enfermedades Infecciosas (CIDR, por sus siglas en inglés), Stefan Kappe. Esta organización sin ánimo de lucro con base en Seattle, en colaboración con investigadores del Centro de Investigación Oncológica Fred Hutchinson, crearon una variedad de Plasmodium falciparum atenuada genéticamente. "Los tres genes borrados en los parásitos debilitados son claves para que se establezca en los hepatocitos y protegerse de las defensas del huésped", explica el investigador germano.
Los investigadores inocularon estos parásitos modificados en una población de mosquitos Anopheles, el vector de la malaria. Allí se desarrollaron hasta llegar a su fase infecciosa (esporozoíto). Entonces, una decena de voluntarios expusieron su antebrazo a la picadura de entre 150 y 200 mosquitos. Querían asegurarse de que el parásito pasaba al humano.
La biología del Plasmodium marca que, una vez en el torrente sanguíneo humano, ha de llegar hasta las células hepáticas, donde pasa por otra fase vital (merozoíto) en la que se multiplica por miles. Es entonces cuando sale del hígado y ataca los glóbulos rojos, donde el proceso se reinicia. Lo que hace esta vacuna es evitar que los merozoítos salgan de las células del hígado.
Tal y como muestran en la revista Science Translational Medicine, la candidata a vacuna (denominada Pf GAP3KO) se mostró segura. Los efectos adversos detectados no fueron más allá de hinchazón, enrojecimiento y picor en la zona de los picotazos. Siendo un ensayo clínico de fase I, la seguridad era el elemento fundamental. También comprobaron que en los 10 casos, el Plasmodium modificado estimuló el sistema inmunitario. Ya en quimeras (ratones con células hepáticas humanas), los investigadores comprobaron que la vacuna las protegía cuando se las expuso a cepas del Plasmodium falciparum con su genes intactos.
"Lo fundamental en esta fase de una investigación es la seguridad, que el parásito no revierta a su carácter patógeno", recuerda la jefa del Grupo de Inmunología de la Malaria del ISGlobal, de Barcelona, Carlota Dobaño. "Es el principal hito de esta investigación", opina. Pero aún queda mucho. Se trata de una muestra muy pequeña, tendrán que hacer más ensayos y con más participantes. Tendrán que encontrar cómo simplificar la inoculación del parásito sin depender de cientos de mosquitos y tendrán que probarla allí donde más se sufre la malaria, en el África subsahariana.
Todo ese camino ya lo ha recorrido la vacuna STS,S desde que se empezara a investigarse hace 40 años. Las OMS pondrá en marcha tres ensayos a gran escala en 2018. Dependiendo de sus resultados, recomendará o no su despliegue masivo. El problema es que, en los últimos ensayos, apenas superó el 50% de niños inmunizados y la protección es temporal. "La RTS,S, se basa en una única proteína del parásito. PfGAP3KO parte de todo el parásito con sus 5.000 genes menos los tres que le borramos, por lo que promete más protección y más duradera", sostiene Kappe.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.
Sobre la firma