El problema de la amiloidosis: más allá del alzhéimer y el párkinson
La placa amiloide puede acumularse en otros órganos del cuerpo, además del cerebro. Las enfermedades resultantes causan mucho sufrimiento
Isabelle Lousada tenía poco más de 30 años cuando colapsó en su boda en Filadelfia en 1995. Lousada, arquitecta londinense, había sufrido una década de síntomas misteriosos: hormigueo en los dedos, tobillos hinchados y vientre distendido por su hígado agrandado. Los médicos a los que consultó inicialmente sugirieron que tenía síndrome de fatiga crónica, o que había estado de fiesta y bebiendo demasiado.
Pero su nuevo cuñado, cardiólogo de profesión, intuyó que algo más debía estar pasando. Una nueva serie de consultas médicas la condujo, finalmente, al diagnóstico correcto: unas proteínas con malformaciones se acumulaban en su torrente sanguíneo y en sus órganos. Esos grandes pegotes de proteína se llaman amiloide y el diagnóstico de su enfermedad fue amiloidosis.
Las enfermedades amiloides que afectan al cerebro, como el alzhéimer y el párkinson, reciben la mayor parte de la atención de los médicos y la prensa. En contraste, las enfermedades amiloides que afectan a otras partes del cuerpo son trastornos menos conocidos y rara vez diagnosticados, dice Gareth Morgan, bioquímico de la Facultad de Medicina Chobanian & Avedisian de la Universidad de Boston. Los médicos pueden tener dificultades para reconocerlos y distinguirlos, especialmente en las primeras etapas.
Las opciones de tratamiento también son limitadas. Lousada, ahora directora ejecutiva del Consorcio para la Investigación en Amiloidosis, una organización sin fines de lucro con sede en Newton, Massachusetts, tuvo la suerte de sobrevivir gracias a un trasplante de células madre que es demasiado agotador o inadecuado para muchas personas con amiloidosis.
Han aparecido varios medicamentos nuevos en los últimos cinco años (y, en opinión de Lousada, “han sido verdaderos agentes de cambio”). Pero, aunque estas terapias pueden bloquear la formación de amiloide nuevo y dañino, no pueden disolver el amiloide que ya se ha acumulado. El cuerpo tiene procesos naturales para hacer eso, pero a menudo son demasiado lentos para eliminar el amiloide acumulado durante años, en especial en personas mayores. Y así, los pacientes siguen sufriendo por el amiloide que obstruye sus órganos y las personas siguen muriendo de amiloidosis, incluso aunque sobrevivan más tiempo que antes.
Los científicos están trabajando en tratamientos más nuevos, incluidos algunos que pueden ayudar a las propias células inmunitarias del paciente a atacar y destruir el amiloide residual.
Cuando el plegado sale mal
Las estructuras amiloides son proteínas naturales del organismo que se desarrollaron terriblemente mal. Cuando la formación de proteínas ocurre con normalidad, las cadenas de aminoácidos se curvan y se pliegan, como un origami preciso, para crear sus formas funcionales finales. Pero a veces, debido a errores genéticos o al envejecimiento, una proteína adopta una forma alternativa e inapropiada que deja expuestos fragmentos que son pegajosos. Las proteínas mal plegadas comienzan a agruparse en pequeños grumos, luego en cadenas más grandes llamadas fibrillas y finalmente en enormes estructuras rectangulares llamadas amiloides. El amiloide puede entorpecer el funcionamiento de las células simplemente interfiriendo en su trabajo, pero también puede interactuar con otras moléculas para producir efectos tóxicos directos.
Hay unas pocas docenas de proteínas humanas que tienen propensión a formar amiloide, y los científicos regularmente agregan alguna más a la lista, dice Fabrizio Chiti, bioquímico de la Universidad de Florencia, Italia, coautor de un artículo sobre proteínas mal plegadas en enfermedades para el Annual Review of Biochemistry. El cuerpo tiene formas de identificar y eliminar estas proteínas mal plegadas, pero con la edad, estas defensas tienden a fallar, por lo que las enfermedades amiloides suelen afectar a las personas mayores.
Una de las enfermedades amiloides más comunes que no afectan el cerebro es la amiloidosis por transtiretina, o ATTR; ocurre cuando una proteína llamada transtiretina se pliega mal. El trabajo normal de la transtiretina es transportar una hormona tiroidea y vitamina A en la sangre hacia diferentes partes del cuerpo. Cuando forma amiloide, el resultado es diferente dependiendo de dónde se depositen las proteínas malformadas. En los nervios periféricos, el amiloide provoca síntomas como hormigueo y entumecimiento en las extremidades. Más comúnmente, el amiloide se forma en el corazón, donde causa síntomas de miocardiopatía, como ritmo cardíaco anormal y dificultad para respirar.
Cada año se diagnostican unos 7.000 nuevos casos de miocardiopatía ATTR en Estados Unidos, pero más personas pueden tener algo de este amiloide en el corazón sin manifestar síntomas, dice Morgan. La miocardiopatía ATTR puede ser responsable de muchos más casos de enfermedad cardíaca de lo que los médicos creen.

El amiloide puede formarse a partir de transtiretina completamente normal, pero otra forma hereditaria de la enfermedad ocurre cuando una mutación genética hace que la proteína transtiretina sea particularmente propensa a plegarse de manera incorrecta. Esa forma de la enfermedad es la que los médicos sospecharon para el caso de Lousada, al menos después de la boda. La ATTR hereditaria puede ocurrir en personas de ascendencia portuguesa, y un médico notó que el apellido de Lousada era de ese país.
Los médicos realizaron una biopsia de hígado y usaron una tinción especial para identificar el amiloide, pero los estudios indicaron que la ATTR no era la respuesta. Resultó que los riñones, el hígado, el bazo y el corazón de Lousada estaban repletos de otro tipo de amiloide formado a partir de una porción de proteína de un anticuerpo.
Nuestros cuerpos producen una gran diversidad de anticuerpos para ayudarnos a defendernos contra innumerables amenazas externas. Pero a veces, una célula inmunitaria comienza a copiarse a sí misma sin control, generando toneladas de un solo tipo de anticuerpo. Tal vez el 1% de las personas mayores de 50 años tienen esta afección sin ningún problema, dice Morgan. Pero si esas células inmunitarias acumulan defectos adicionales pueden apoderarse de la médula ósea y convertirse en un tipo de cáncer de la sangre llamado mieloma múltiple. O si los anticuerpos producidos en exceso incluyen segmentos mal plegados en una parte del anticuerpo llamada cadena ligera, el resultado es amiloidosis de cadena ligera, o AL.
La amiloidosis AL causa una variedad de síntomas, que incluyen, comúnmente, daño renal o cardíaco. En etapas avanzadas, la lengua puede hincharse con amiloide y los vasos sanguíneos alrededor de los ojos pueden dañarse. “Es casi como tener los ojos morados todo el tiempo”, dice Morgan. Aunque la AL es la otra forma más común de amiloidosis no cerebral, solo se diagnostican unos 3.200 casos al año en Estados Unidos.
El diagnóstico de AL de Lousada se hizo hace décadas y tuvo suerte: finalmente, una terapia funcionó, pero no de inmediato. Los médicos primero probaron con quimioterapia, pero su enfermedad siguió empeorando, y en Londres los especialistas le dieron de alta enviándola a cuidados paliativos, pues estimaban que le quedaban meses de vida.
De nuevo, su cuñado vino al rescate y la conectó con un hospital en Boston que estaba haciendo trasplantes de células madre (un tratamiento para mieloma múltiple) en pacientes con AL. La idea era eliminar la médula ósea de la que surgen las células inmunitarias y luego reemplazarla con una nueva médula de un donante. Esto debería eliminar las células que generaban la proteína de cadena ligera problemática.
Lousada se sometió al tratamiento, que requirió meses en el hospital, y tardó años en recuperarse por completo.
Como en el caso de AL, las opciones de tratamiento para ATTR también eran limitadas y difíciles en el pasado. La mayor parte de la transtiretina se produce en el hígado, por lo que un trasplante de hígado puede ayudar a algunas personas que padecen la forma hereditaria. Pero eso hace que los pacientes deban tomar inmunosupresores de por vida, para que no rechacen el nuevo hígado.
Se necesitaban desesperadamente más opciones y años atrás, mucho antes de que Lousada se enfermara, los investigadores estaban trabajando en el problema.
Una variedad de enfoques farmacológicos
Desde 1989, el neurobiólogo químico Jeffery Kelly se había propuesto desarrollar medicamentos para la ATTR. Kelly, que ahora trabaja en el Instituto Scripps Research en La Jolla, California, sabía que la transtiretina normal consta de cuatro proteínas individuales unidas y que, en esa forma, no puede plegarse mal ni generar amiloide. Entonces pensó que si podía usar una molécula pequeña para fijar a las cuatro moléculas de transtiretina en la forma adecuada podría evitar que adquiriera una forma nueva y dañina.
En varios estudios y por más de una década, el equipo de Kelly probó alrededor de 1.000 moléculas potenciales en tubos de ensayo para determinar la capacidad de estabilizar la transtiretina. Cuando se forma amiloide, las soluciones contenidas en los tubos se vuelvan turbias u opacas bajo la luz violeta y luz ultravioleta cercana, de modo que los científicos podían medir cuándo los medicamentos inhibían la creación de amiloide. Después de hacer modificaciones químicas en los fármacos candidatos se decidieron por una molécula llamada tafamidis.
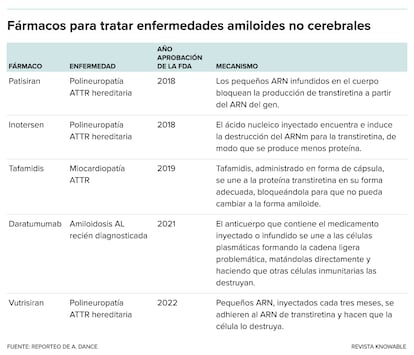
Kelly cofundó la empresa FoldRx para desarrollar el fármaco, y Pfizer adquirió FoldRx en 2010. En un ensayo internacional, los investigadores estudiaron a 128 personas que tenían polineuropatía debido a la mutación de la transtiretina, la misma que los médicos alguna vez sospecharon para el caso de Lousada. El medicamento disminuyó la velocidad a la que empeoraron sus síntomas. Este estudio, que se centró en personas con neuropatía y se publicó en 2012, llevó a la aprobación de tafamidis en varios países. Un segundo ensayo en 441 pacientes que tenían una enfermedad cardíaca causada por ATTR mostró que el fármaco redujo las hospitalizaciones y muertes relacionadas con problemas cardiovasculares y enlenteció la pérdida de calidad de vida, lo que llevó a que la Administración de Alimentos y Medicamentos de EE.UU. (FDA) aprobara el fármaco para la miocardiopatía ATTR en 2019.
En la actualidad, dice Kelly, hay unas 30.000 personas que toman tafamidis en el mundo, pero cree que muchas más podrían beneficiarse si fuera más fácil diagnosticar la ATTR.
Otros investigadores están desarrollando medicamentos utilizando diferentes enfoques. Por ejemplo, mientras que el tafamidis estabiliza la transtiretina, otros científicos han decidido eliminar la proteína en sí. Eso es posible porque hay otras proteínas que pueden hacer el trabajo de transporte que hace la transtiretina, dice el médico David Lebwohl, director médico de Intellia Therapeutics en Cambridge, Massachusetts. La compañía está utilizando una forma de terapia génica para desactivar el gen de la transtiretina en el hígado de pacientes con ATTR.
En un ensayo inicial con 15 personas con polineuropatía ATTR hereditaria, el tratamiento fue seguro y redujo la cantidad de transtiretina presente en la sangre en un promedio de 93% en la dosis más alta. Intellia espera comenzar un ensayo más amplio que analice el fármaco en pacientes con miocardiopatía ATTR para finales de 2023. Si tiene éxito, esta terapia de Intellia podría unirse a otros tres tratamientos genéticos antitranstiretina que han aparecido en los últimos cinco años: inotersen, patisiran y vutrisiran. Estos medicamentos usan pequeños fragmentos de ácido nucleico que bloquean la producción de transtiretina, sin desactivar el gen como lo hace la estrategia de Intellia.
Las cosas también están mejorando para los tratamientos contra la amiloidosis AL. En 2021, la FDA aprobó una terapia que contenía daratumumab, otro fármaco contra el mieloma múltiple, para usar específicamente contra la AL. Al igual que la molécula detrás de la enfermedad, este tratamiento es un anticuerpo, pero uno completamente diferente. El anticuerpo daratumumab se adhiere a las células inmunitarias problemáticas que están produciendo cadenas ligeras. Actúa como una etiqueta que alerta a otros elementos del sistema inmunitario para que destruyan las células problemáticas. Una vez que se han ido, ya no pueden diseminar el anticuerpo AL problemático.
Y Kelly, inspirado por su anterior éxito en la estabilización de proteínas, espera aplicar la estrategia de tafamidis a la AL. Junto a Morgan, que solía trabajar en su laboratorio, están a la caza de pequeñas moléculas que fijen la cadena ligera del anticuerpo en su forma adecuada para que no pueda plegarse mal. Esto es más desafiante que para la transtiretina, dice Morgan, porque cada persona con AL tiene una cadena ligera diferente detrás de su enfermedad. Necesitan una molécula que las estabilice a todas y cada una de ellas.
Después de examinar más de 650.000 moléculas pequeñas, Morgan y Kelly encontraron varios candidatos. Basados en pruebas bioquímicas y estudios de estructuras moleculares, piensan que estas drogas potenciales pueden deslizarse en el espacio entre cualquier par de cadenas ligeras y mantenerlas en su forma adecuada. El equipo ha hecho ajustes químicos para crear moléculas que hagan esto aún mejor. El siguiente paso será probar estos fármacos candidatos en muestras de sangre de pacientes en el laboratorio de Morgan, para ver si pueden estabilizar las proteínas de cadena ligera de personas que se sabe que tienen AL. Kelly cofundó otra empresa, Protego, para llevar este medicamento al mercado (Kelly también forma parte del consejo asesor científico del Consorcio de Investigación de Amiloidosis).
Atacando directamente al amiloide
Aunque estos nuevos medicamentos detienen la formación de amiloide es difícil decir cuánto ayudan con el amiloide que ya está presente en los pacientes, lo que puede hacer que persistan los síntomas.
Los científicos sospechan que, con el tiempo, el sistema inmunitario —al menos en las personas más jóvenes— pueda identificar y eliminar esta basura residual de proteínas. Pero algunos investigadores están trabajando en encontrar formas de facilitar la eliminación directa de amiloide, como desarrollar anticuerpos que lleven a las células inmunitarias a tomar una forma específica de amiloide, o incluso a cualquier forma de amiloide. Esos anticuerpos pan-amiloides, en teoría, beneficiarían no solo a los pacientes con ATTR o AL, sino también a quienes padezcan otras enfermedades amiloides. Ya existe un nuevo fármaco de anticuerpos para el alzhéimer, llamado lecanemab, que identifica el amiloide asociado con esa enfermedad y parece reducir su cantidad.
Y Kelly, quien es coautor de un artículo sobre enfermedades del mantenimiento de proteínas en el Annual Review of Biochemistry, está interesado en acelerar un proceso natural llamado autofagia. Este proceso es usado por las células del cuerpo cuando presentan algo que es peligroso, está dañado o simplemente ya no es útil. Así, desvían la basura a una bolsa ácida llamada lisosoma, donde se destruye.
Las células inmunitarias, por ejemplo, usan la autofagia para destruir la basura que recogen, que es probablemente la forma en que los jóvenes con sistemas inmunitarios activos pueden deshacerse del amiloide residual. Pero Kelly sospecha que algunos de estos mecanismos de autofagia quedan inactivos en las personas mayores y los defectos en la autofagia se han vinculado a enfermedades neurológicas amiloides.
Kelly espera que aumentar la autofagia en personas mayores con amiloidosis permitirá que sus células inmunitarias envejecidas eliminen la basura adecuadamente. Presume que esto funcionaría en cualquier forma de amiloide, en el cerebro y en el resto del cuerpo.
Para encontrar moléculas que promuevan la autofagia, el equipo empezó probando 940.000 moléculas pequeñas para identificar aquellas que pudieran promover la destrucción de las gotas de grasa, que son objetivos naturales de la autofagia, y también otros métodos de degradación, en células que crecen en placas de laboratorio. Luego tomaron los que tuvieron mejores resultados y los probaron específicamente para la activación de la autofagia, y para medir la autofagia exitosa, utilizaron la desaparición de un trozo de proteína verde brillante a medida que se digería.
Como se dio a conocer en un artículo publicado como preimpresión, un fármaco candidato prometedor redujo la cantidad de amiloide en células cultivadas en el laboratorio que produjeron uno de los dos amiloides bien conocidos: el amiloide de proteína tau, relacionado con la enfermedad de Alzheimer, o una proteína amiloide asociada a lo que se conoce como enfermedad de la vaca loca. Los investigadores aún necesitan comprender el mecanismo del fármaco, por ahora llamado CCT020312, antes de comenzar los ensayos clínicos.
El estudio de la amiloidosis ha recorrido un largo camino en las últimas tres décadas. “Es un momento realmente increíble para estar en este campo, porque han sucedido muchas cosas”, dice Morgan. El experto avizora un día en que los tratamientos combinarán varios enfoques: detener la producción de la proteína problemática, como hacen el daratumumab y la terapia génica; estabilizar la proteína que todavía se produce, como lo hace tafamidis; y limpiar el amiloide residual, como pretenden hacer los enfoques del sistema inmunitario.
Con el tiempo, quizás, más personas con amiloidosis tendrán resultados sorprendentes como los que tuvo Lousada, pero con tratamientos mucho menos onerosos que un trasplante. Veintisiete años después de su diagnóstico, Lousada está completamente recuperada, aunque todavía se somete a análisis de sangre regulares para verificar si la cadena ligera se está acumulando nuevamente en su cuerpo. Junto a su esposo tienen tres hijos, se mudaron a Estados Unidos y ella se ha convertido en activista de la investigación de la amiloidosis. “Cuando salí de esta experiencia, realmente sentí que podría hacer algo que tuviera más significado e impacto que la arquitectura”, dice. “En todos los sentidos, cambió la trayectoria de mi vida”.
Artículo traducido por Debbie Ponchner
Este artículo apareció originalmente en Knowable en español, una publicación sin ánimo de lucro dedicada a poner el conocimiento científico al alcance de todos.
Puedes seguir a EL PAÍS Salud y Bienestar en Facebook, Twitter e Instagram.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.




























































