La edición genética cura a ratones sordos
Mediante una inyección, los científicos desactivaron un gen defectuoso en las células del oído interno
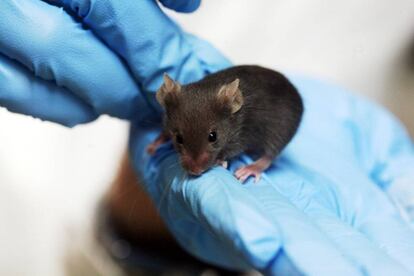
Los ratones de laboratorio de la cepa Beethoven, como el famoso compositor alemán, no oyen. Padecen un tipo de sordera hereditaria que también aflige a las personas y que degenera rápidamente al poco de nacer. Un equipo de científicos de China y EE UU ha conseguido devolver la audición a varios de estos ratones utilizando el sistema de edición genética CRISPR, según publica la revista Nature. Su logro abre el camino hacia un tratamiento clínico para los casos de sordera genéticos, que por ahora tienen difícil solución.
En el caracol del oído interno, células especializadas convierten la información del sonido en impulsos nerviosos. Este proceso corre a cargo de unas estructuras celulares finísimas, los cilios, que captan las vibraciones del canal auditivo. Sin embargo, la mutación genética de una sola letra del ADN de la proteína llamada TMC1 produce un defecto en estas estructuras que lleva a la muerte de las células auditivas, y así a la sordera. Basta con que uno de los dos padres transmita esta mutación para que el hijo nazca con pérdida de audición progresiva y deje de oír completamente durante la adolescencia.
Lo mismo ocurre con los ratones Beethoven. En el núcleo de cada célula tienen dos copias del gen TMC1: una sin mutar y otra con la mutación que produce la proteína defectuosa. Para curar la enfermedad, solo la copia dañina debe ser desactivada, para que el gen que produce la proteína funcional pueda actuar con normalidad. “Es como un dueto de dos cantantes”, explica el biólogo Fyodor Urnov, del Altius Institute for Biomedical Sciences de Seattle, EE UU, en una nota anexa al estudio de Nature. “Si una persona desafina, debe ser silenciada selectivamente para poder escuchar la melodía correcta, porque si se detiene a ambos cantantes, la música cesará”.
Con este fin, los investigadores utilizaron el sistema de edición genética CRISPR-Cas9, que se puede programar para producir cortes solo en la sección deseada del ADN. Cas9 es una enzima que corta los cromosomas, y va asociada a una pequeña secuencia de ARN que utiliza para identificar el gen que debe atacar. En este caso, los biólogos programaron el sistema con ARN complementario al gen defectuoso de TMC1. Fue “una sorpresa agradable” comprobar que la enzima es capaz de discriminar este objetivo del gen que produce la proteína sana, dice el autor David Liu de la universidad de Harvard, ya que las dos secuencias de ADN solo se diferencian en una letra.
El reto final fue administrar el tratamiento. Normalmente, la edición genética en organismos vivos se lleva a cabo utilizando un virus que inserta genes nuevos en las células para que la propia maquinaria del organismo ensamble las moléculas de edición. En este caso, los autores razonaron que, una vez la enzima Cas9 desactivase el gen mutado, ya habría cumplido su función y no haría falta continuar con su fabricación en las células curadas. Así, decidieron no utilizar virus, sino administrar la enzima directamente a las células auditivas de los ratones con una inyección en el oído interno.
Los ratones tratados se asustan al escuchar ruidos fuertes; esto no ocurre en los ratones Beethoven normales
Para que la maquinaria reparadora del sistema CRISPR-Cas9 pudiese penetrar las células sin producir daños, los investigadores envolvieron Cas9 y el ARN de guía en gotitas de aceite que se fusionan con las membranas protectoras de las células. “Cuando inyectamos a los ratones en un oído, las células auditivas en ese oído mostraron una salud muy superior a la del oído sin tratar, y también preservaron mejor audición”, explica Liu. “Los ratones tratados se asustan al escuchar ruidos fuertes; esto no ocurre en los ratones Beethoven normales”.
Aunque quedan por resolver problemas en torno a la eficacia y seguridad del tratamiento en humanos, los autores se muestran optimistas cuando hablan del futuro de la intervención. “Teníamos resultados prometedores en cultivos de laboratorio, pero no sabíamos cómo de bien se traducirían al aplicarlos a animales vivos”, dice Liu. “Estamos muy emocionados con el resultado”. Y tienen motivos para estarlo: las terapias de edición genética ya están llegando a los ensayos clínicos, como por ejemplo el tratamiento de anulación del gen Ccr5 en células del sistema inmune para reducir la carga vírica en pacientes de sida, o la modificación de células inmunes para atacar tumores. Ahora, los autores deberán probar su tratamiento en animales más similares a los humanos, como primates, aunque seguirán buscando aplicaciones de su técnica para otras enfermedades genéticas en paralelo.
Terapias génicas para el oído
Desactivar un gen defectuoso solo es un tratamiento viable cuando las células tienen al menos otra copia funcional del ADN. En otros casos hereditarios de sordera, el problema es una mutación que afecta a todas las copias de un gen, de manera que el organismo no tiene forma de producir la proteína sana.
Esto ocurre con el síndrome de Usher, una enfermedad genética que afecta al oído, a la vista y al equilibrio, y que se adquiere al heredar una mutación del gen Ush1c tanto del padre como de la madre. Hace unos meses, un equipo de Harvard (EE UU) liderado por Gwenaëlle Géléoc restauró la audición a ratones con este síndrome mediante la inyección de un virus con una copia normal del gen. Las células del oído asimilaron el ADN del virus y empezaron a producir la proteína con normalidad, curando la sordera de los ratones.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.




























































