Cómo curar 10.000 enfermedades
CRISPR resulta tan eficaz y costeable que ya ha puesto al alcance de la ciencia actual la erradicación de las enfermedades raras que se deben a la mutación de un solo gen

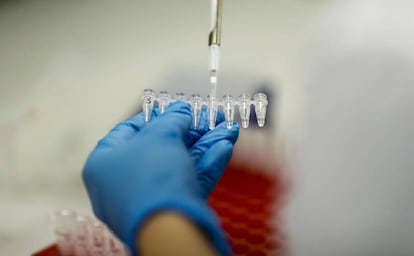
Hay resultados científicos que son importantes porque resuelven un viejo enigma y hacen así avanzar nuestro entendimiento del mundo. El que conocemos hoy lo es porque abre un nuevo continente a la investigación biomédica, y por tanto a la medicina del futuro próximo. La enfermedad hereditaria que los investigadores han curado en embriones humanos es relevante en sí misma: una cardiopatía congénita a menudo mortal que afecta a una de cada 500 personas, o cerca de 100.000 españoles. Pero lo esencial es que esta misma técnica de edición genómica, llamada CRISPR, se puede utilizar también sobre cualquier otra de las 10.000 enfermedades causadas por la mutación de un solo gen.
En conjunto, estas ‘enfermedades raras’ suponen una carga importante para los sistemas sanitarios y una fuente trágica de sufrimiento para una parte sustancial de la población humana. Pero cada una afecta a tan poca gente que resulta muy difícil encontrar financiación para investigar cada una por separado. Cada una afecta a un órgano o proceso fisiológico distinto, y la esperanza de encontrar terapias eficaces una por una es escasa. Pero hay una cosa que todas tienen en común: se deben a la mutación de un gen en alguno de los padres y, por tanto, todas son susceptibles a una estrategia de reparación genética. Y, como demuestra el trabajo de hoy, ya disponemos de esa estrategia. Se llama CRISPR, y resulta tan eficaz y costeable que ya ha puesto al alcance de la ciencia actual la erradicación de las 10.000 enfermedades raras que se deben a la mutación de un solo gen. Esto son grandes noticias.
Dicho lo cual, es obligado dedicar el resto de este artículo a evitar un entusiasmo prematuro, y la consiguiente decepción. Para empezar, estamos hablando todavía de ciencia básica. Con embriones humanos, sí, y reparando unos genes que causan enfermedades humanas muy reales y concretas. Pero es ciencia básica. Los embriones se han curado, pero no se han implantado en ninguna mujer. Llegar a eso va a requerir no solo mucha más investigación fundamental, sino también un amplio debate social y, llegado el caso, unas reformas legales sustanciales en todos los países que han legislado sobre embriología.
Todos estos países tienen prohibida la modificación genética de la línea germinal (las células que dan lugar a los óvulos y los espermatozoides, y los propios embriones que resultan de su fusión). Hace 10 o 20 años esa prohibición parecía lógica, pero ahora supone un escollo formidable para el avance de la biomedicina. Si los ciudadanos decidimos apoyar estos avances, habrá que cambiar las leyes tras un debate racional en el Parlamento. Si decidimos lo contrario, estas investigaciones no podrán llegar al paciente.
No todos los países aplican unas exigencias tan altas a sus laboratorios. Uno de los que tiene una manga más ancha, al menos en estas cuestiones embriológicas, es China, cuyos científicos ya utilizaron hace un par de años la técnica de edición genómica CRISPR para modificar embriones humanos, sin llegar a implantarlos en una mujer. Estos experimentos prematuros sirvieron sobre todo para revelar los grandes obstáculos técnicos que quedaban por salvar para permitir al método alguna esperanza de llegar a su aplicación clínica. Y también para encender un debate mundial sobre la cuestión. Un debate no solo científico –no debe ser solo eso—, sino también ético y jurídico. La investigación que conocemos hoy ha resuelto los mayores obstáculos técnicos y de seguridad. Pero, por supuesto, no puede resolver las cuestiones éticas. Esa es una tarea para la sociedad y sus representantes, y la nueva investigación no hace más que enfatizar su necesidad con un fulgor deslumbrante. Si hay algún político leyendo esto, ojalá tome nota.
Estados Unidos lo está haciendo muy bien. A consecuencia de aquellas investigaciones chinas, la Academia Nacional de Ciencias formó un comité científico y ético para elaborar un documento de recomendaciones. El español Juan Carlos Izpisúa, del Instituto Salk de California, es uno de sus miembros. El informe se publicó en febrero, y como mínimo es un buen de partida para el necesario debate internacional.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.




























































