Los ribosomas, máquinas de hacer vida
Las factorías de proteínas, cuyo estudio ha merecido el Nobel de Química, son diferentes en humanos y bacterias y en eso se basa la acción de varios antibióticos
Los ribosomas, encargados de ensamblar uno a uno los aminoácidos que componen cada proteína, son los operarios más complejos en el proceso de mantener la vida de las células. Vivimos gracias a que la información heredada de nuestros padres, contenida en el ADN, se convierte en moléculas, todas las que forman nuestras células y las hacen funcionar. La información del ADN está escrita en un lenguaje que solo entienden varias estructuras -ribosomas, polimerasas, ARNs- que en cada célula se dedican a copiar, transcribir y traducir lo que allí se dice para convertirlo en todo el contenido celular, en célula viva.
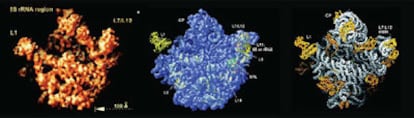
La estructura de los ribosomas no fue fácil de determinar, están compuestos por demasiadas piezas (de proteína y de ácido ribonucleico) y, aunque de tamaño submicroscópico, son demasiado grandes para que las técnicas usadas para averiguar la estructura del ADN los pudieran cartografiar. Tras disponer de muchos datos y avances técnicos, los equipos de Ramakrishnan, Steitz y Yonath determinaron en el año 2000 cómo las distintas piezas encajan en el gran rompecabezas.
El trabajo que Ada E. Yonath inició hacia 1980 fue crucial para conseguir cristales de ribosomas bacterianos con la calidad necesaria para que se obtuvieran buenos datos con las técnicas de difracción de rayos X capaces de revelar el lugar que los átomos ocupan en una estructura. Fue dieciocho años después cuando el grupo de Thomas A. Steitz obtuvo alguna pista sobre la estructura reconstruyendo la apariencia tridimensional a baja resolución de una de las dos subunidades que forman cada ribosoma a partir de imágenes de subunidades congeladas obtenidas al microscopio electrónico. La imagen aproximada de la otra subunidad la obtuvo el grupo de Venkatraman Ramakrishnan, también en 1998. Al avance también contribuyó la utilización del sincrotrón como una mejor fuente de radiación y datos genéticos que permitieron obtener algunas variantes de ribosomas que eran más fáciles de observar. Estos resultados iniciales permitieron avanzar con mayor rapidez, y solo pasaron tres años más para que entre los tres grupos tuvieran una imagen de alta resolución del ribosoma completo.
Una de las sorpresas que se descubrió al ver la estructura del sitio donde se produce el engarce de un aminoácido con otro es que no es un receptáculo de proteína, sino que lo que más hay allí es ARN, el otro componente de los ribosomas. La observación inicial se interpretó como que el ribosoma es una ribozima (un ARN catalítico), y que posiblemente se conservó así desde el momento en el que la vida se iniciase en un mundo de RNA, en el que este tipo de molécula, no solo llevaba la información del ADN de un lado a otro, sino que tenía un importante papel funcional. Pero los resultados posteriores han aclarado que la actividad del ribosoma deriva de un terceto: uno de sus RNAs, una de sus proteínas, y otro RNA al que va unido cada aminoácido y que se va quedando en el sitio del ribosoma que ocupa la proteína naciente según crece. Cómo se originó la vida parece pues algo más complejo de lo que en principio parecía.
Todas las células utilizan ribosomas para producir proteínas, pero nuestros ribosomas son diferentes de los de las bacterias, para empezar son de más tamaño. En esas diferencias se basa la acción de varios antibióticos, la estreptomicina entre los más antiguos y el linezolid entre los más nuevos, que bloquean la síntesis de proteínas en las bacterias y las matan, mientras que no perjudican a nuestro cuerpo. El 50% de los antibióticos actúa sobre los ribosomas. Conocer su estructura a nivel atómico enseguida permitió determinar muchos detalles sobre cómo funcionan varios antibióticos y también sentar las bases para en el futuro encontrar otros nuevos, algo cada vez más necesario para tratar a las bacterias que, frente al gran uso y muchas veces el abuso o mal uso de estas medicinas, se han hecho resistentes a los tratamientos más comunes.
Miguel Vicente es profesor de Investigación en el Centro Nacional de Biotecnología - CSIC
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.




























































