Una inyección de esperanza para detener la malaria
Mosquirix, la primera vacuna contra el paludismo, se empezó a administrar a niños en Malawi. Su eficacia es limitada y preocupa su seguridad, pero es la respuesta a una enorme necesidad: 400.000 muertes al año

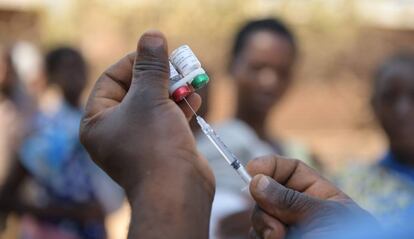
En una pequeña sala del Centro de Salud de Phalula, en Balaka, un distrito del sur de Malawi, dos jóvenes madres están sentadas en un banco de madera, cada una con un bebé de cinco meses en el regazo. Frente a ellas, tras una mesa, se encuentra Alfred Kaponya, sanitario de la comunidad. Uno de sus compañeros se apresura a preparar una vacuna, dando golpecitos en la jeringa para eliminar las burbujas. Kaponya explica el procedimiento a las mujeres, anota el número de serie de las vacunas en el libro de vacunaciones de los bebés, y lo copia en una hoja de cálculo que lleva en la carpeta.
A continuación, una de las madres desnuda el muslo de su hijo para que le pongan la inyección; este empieza a llorar y ella le da palmaditas en la espalda. El procedimiento se repite con el otro bebé, una niña.
Tal vez parezca algo normal, pero no es así. Estos dos niños acaban de recibir la primera vacuna de la malaria que supera la fase de prueba clínica, un hito en la batalla contra una enfermedad que cada año se cobra más de 400.000 vidas, la mayoría de niños africanos. Tras 30 años de investigación, la RTS,S también conocida por su nombre comercial, Mosquirix, tiene como objetivo el Plasmodium falciparum, la más común y letal de las cuatro especies de parásitos que provocan la malaria. Es una respuesta a una enorme necesidad. Tras décadas de descenso del número de casos y fallecimientos, la lucha contra la malaria se ha estancado. Los parásitos resistentes al tratamiento más ampliamente utilizado, una terapia de combinación basada en la artemisinina, se están propagando, mientras que los mosquitos transmisores son cada vez más resistentes a los insecticidas.
Y sin embargo, el comienzo de la vacunación, aquí y en otros dos países africanos, no es el gran avance que los especialistas esperaban. La eficacia y la durabilidad del Mosquirix son mediocres: cuatro dosis ofrecen solo un 30% de protección frente a la malaria severa, durante no más de cuatro años. Algunos expertos cuestionan si merece la pena el gasto y el esfuerzo.
Sin embargo, las mayores preocupaciones tienen que ver con la seguridad de la vacuna. En el ensayo más grande, los niños vacunados con Mosquirix tuvieron 10 veces más riesgo de meningitis que los que recibieron solo una vacuna de control. Tal vez el Mosquirix no provocara los casos de meningitis —hay otras explicaciones posibles— pero el posible riesgo ha preocupado tanto a la comunidad sanitaria mundial que, en lugar de comenzar la vacunación en toda África, la Organización Mundial de la Salud (OMS) decidió poner en marcha un programa piloto de vacunación en Malawi, Ghana y Kenia, donde la vacuna se administrará a cientos de miles de niños.
El programa piloto no es un ensayo clínico, sino una campaña de vacunación fuertemente controlada para recopilar más datos que permitan certificar si el Mosquirix es seguro y eficaz antes de una introducción más amplia. “Creo que la vacunación piloto es una forma científica y pragmática de avanzar”, afirma Marcel Tanner, exdirector del Instituto Suizo de Medicina Tropical y Pública en Basilea, que ha participado en varios estudios clínicos sobre esta inmunización. “Es una forma de controlar todos los aspectos de la vacuna y observar si ocurre algo”.
Pero efectuar un seguimiento a los niños vacunados es una tarea abrumadora en un país como Malawi, que carece de sistemas digitales para registrar estadísticas de salud o de mortalidad. “Cuando decidimos que era necesario el programa piloto, no tuvimos en cuenta los mecanismos o repercusiones prácticas”, reconoce Peter Smith, epidemiólogo que trabaja en la Escuela de Higiene y Medicina Tropical de Londres (LSHTM por sus siglas en inglés) y es asesor científico del programa piloto. Sus detractores siguen dudando de que esta vacunación piloto proporcione un veredicto claro sobre el potencial del Mosquirix en el mundo real.
El parásito de la malaria es un blanco difícil para una vacuna. Tiene un ciclo vital complejo que comienza cuando un mosquito hembra infectado pica a un humano y escupe células de Plasmodium llamadas esporozoítos en el torrente sanguíneo. Dichas células se multiplican en el hígado, de donde salen en otra fase celular, denominada merozoitos, para invadir las células sanguíneas y seguir multiplicándose. Las células sanguíneas se rompen, causando fiebre, dolor de cabeza, escalofríos, dolor muscular y a menudo anemia (también inundan la sangre de gametocitos —las células reproductivas del parásito— listos para ser absorbidos por el siguiente mosquito). Por el camino, el parásito cambia con frecuencia sus proteínas superficiales. Eso lo convierte en un blanco escurridizo para el sistema inmunitario, y para cualquier vacuna.
El Mosquirix, desarrollado en Bélgica en la década de 1980 por un equipo de SmithKline-RIT, ahora GlaxoSmithKline (GSK), estimula una respuesta inmunitaria contra una proteína que se produce solo en la superficie de los esporozoítos. Para aumentar la respuesta, el equipo investigador fundió la proteína de la vacuna con una proteína superficial de la hepatitis B y añadió un adyuvante. “En aquel momento muchos se mostraron escépticos, porque había habido múltiples intentos con sus consiguientes fracasos”, explica el biólogo molecular Joe Cohen, que dirigió el equipo investigador de GSK hasta su jubilación, en 2012.
Los partidarios de poner en marcha la vacunación sostenían que una vacuna imperfecta era mejor que ninguna. Otros, que el Mosquirix no era suficientemente seguro
Pero los resultados del primer ensayo a gran escala, efectuados en 2000 niños de uno a cuatro años en Mozambique, fueron prometedores: las infecciones por malaria en los seis meses posteriores a la vacunación disminuyeron un 58%, informaban Cohen y sus colaboradores en un artículo publicado en 2004 en The Lancet. Un ensayo aún mayor que incluyó 15.000 niños de siete países africanos entre 2009 y 2011 obtuvo resultados desiguales. Entre los bebés que recibieron la primera dosis entre las seis y 12 semanas de vida, la eficacia contra la malaria severa fue prácticamente nula. Eso difuminó las esperanzas de que la vacuna pudiera proteger al grupo más vulnerable, y que pudiera administrarse junto con las demás vacunas para bebés, dice Smith. Pero entre los niños de vacunados inicialmente entre los 17 y 25 meses las infecciones por malaria disminuyeron en total un 40%, y las infecciones severas, un 30%.
Son porcentajes miserables en comparación con la vacuna del sarampión, que protege al 97,5%. “Pero nadie esperaba realmente conseguir una eficacia muy alta, porque la malaria es una enfermedad muy complicada”, confiesa Smith. Los ensayos también revelaron que, a pesar de administrar tres dosis en intervalos de un mes, la protección cae prácticamente a cero en un plazo aproximado de año y medio. Una dosis de recuerdo administrada en ese momento potencia el efecto protector, pero vuelve a caer 18 meses después. Aun así, a pesar de su corta duración, una vacuna parcialmente eficaz “podría suponer ya una enorme diferencia”, dice Smith. Cohen señala que ofrece alguna protección durante un periodo crucial: “El periodo real en el que los niños corren el riesgo de padecer la forma severa de la enfermedad y morir se sitúa por debajo de los cinco años”.
La Agencia Europea del Medicamento (AEM) coincide en esta idea. En julio de 2015 declaró que la vacuna era suficientemente segura y eficaz como para ser introducida en África, mediante un procedimiento especial diseñado para ayudar a los organismos reguladores de los países en desarrollo a tomar decisiones.

Eso no puso fin a las dudas. Algunos científicos temían que la vacuna fuese menos eficaz en el mundo real que en los estudios, comenta Brian Greenwood, director del estudio e investigador de la malaria en la LSHTM, porque la población podría contar con la protección de la vacuna y ser menos cuidadosa. “¿Y si dejasen de dormir protegidos por las mosquiteras o los padres ya no llevasen a sus niños febriles a la clínica para hacerles la prueba de la malaria? Habría que vigilar eso”, explica. A otros les preocupaba que la inversión en el Mosquirix se produjera a expensas de otros métodos de prevención de la malaria. La serie completa de cuatro dosis cuesta unos 20 dólares, frente a los cinco de una mosquitera y el 1,50 que cuesta administrarle a un niño un tratamiento farmacológico profiláctico durante la estación de lluvias. “Hay medidas eficaces disponibles que pueden utilizarse aún mejor”, considera Micaela Serafini, trabajadora de Médicos Sin Fronteras en Ginebra, Suiza.
Al mismo tiempo, los datos de seguridad eran desconcertantes. Aproximadamente 20 de los 6.000 niños vacunados contra la malaria en el ensayo de siete países contrajeron meningitis, frente a un niño de los 3.000 vacunados en el grupo de control, que recibieron dosis de vacuna contra la rabia. Supone una multiplicación del riesgo por 10. Un tercio de los niños que contrajeron meningitis falleció. El equipo de investigación y la AEM creen que fue un resultado casual. Los episodios de meningitis se produjeron a intervalos aleatorios tras la vacunación, la mayoría de ellos en dos de los siete lugares de estudio, y no hay una buena explicación de por qué el Mosquirix podría dar lugar a una meningitis, como sostienen los autores del artículo publicado en The Lancet. Otros científicos han insinuado que la diferencia puede deberse a la vacuna de la rabia administrada a los niños del grupo de control. Ese grupo experimentó una tasa notablemente baja de meningitis, lo que da a entender que, de algún modo, la vacuna de la rabia podría tener un efecto preventivo contra esta enfermedad.

Los debates sobre el Mosquirix alcanzaron su apogeo en una reunión celebrada en la sede de la OMS en Ginebra, en octubre de 2015. Los partidarios de poner en marcha la vacunación, incluidos muchos representantes africanos, sostenían que una vacuna imperfecta era mejor que ninguna. Otros, principalmente expertos en vacunación, sostenían que el Mosquirix no era suficientemente seguro y eficaz para su introducción.
Un experto relativamente ajeno a la reunión, el antropólogo e investigador de vacunas danés Peter Aaby, que colabora con el Proyecto Sanitario Bandim en Guinea-Bissau, ofreció otro argumento en contra de la introducción. Tras volver a analizar los datos obtenidos del ensayo más amplio, Aaby descubrió que si bien los niños vacunados padecían malaria con menor frecuencia, no morían con menor frecuencia. Entre las niñas, la mortalidad total prácticamente se duplicó, comentó Aaby a los compañeros presentes en la reunión. “Esta vacuna está matando a las niñas”, recuerda que dijo. Mientras que la OMS espera que la vacuna salve una vida por cada 200 niños vacunados, Aaby cree que uno de cada 200 niños morirá a causa de la misma; él predice “una pesadilla”.
Aaby y Christine Stabell Benn, catedrática de salud mundial en la Universidad del Sur de Dinamarca, tienen una explicación. Este matrimonio lleva décadas estudiando las vacunaciones ordinarias en África y cree que las vacunas pueden “enseñar” al sistema inmunitario de maneras que no solo afectan a la enfermedad contra la que van dirigidas. Las vacunas que contienen un patógeno vivo y debilitado —como la del sarampión y la tuberculosis— fortalecen el sistema inmunitario en general, afirman Aaby y Stabell Benn, permitiendo a los receptores luchar mejor contra otras infecciones. Pero las vacunas que contienen un patógeno muerto o solo porciones del patógeno debilitan el sistema inmunitario, sostiene su teoría, en especial en las niñas, cuyo sistema inmunitario parece responder con más fuerza a las vacunas en general.

Pocos comparten las preocupaciones de Aaby acerca del Mosquirix. Mary Hamel, profesional de la OMS que dirige desde Ginebra la vacunación piloto con Mosquirix, afirma que el ensayo no estaba diseñado para estudiar la mortalidad. El simple hecho de participar en él hizo que los niños recibieran mejor atención, y su mortalidad disminuyó en un 70% respecto a niños de lugares cercanos al ensayo no incluidos. “La sorpresa", dice Hamel, "fue la baja mortalidad en las niñas que recibieron la vacuna de la rabia". Tanner opina que Aaby ha “enriquecido nuestro campo”, pero “se ha convertido en una especie de misionero con respecto a los efectos inmunitarios inespecíficos. Confío en que la vacuna tendrá en conjunto un efecto positivo sobre la mortalidad”. Pero la presentación de Aaby en la reunión intensificó las dudas. En un momento dado, dio la impresión de que se abandonaría por completo la vacuna, dice Greenwood.
Para zanjar estas preocupaciones, los asistentes acordaron establecer una administración piloto en tres países. En cada país, el equipo de la OMS y el Gobierno respectivo seleccionarían al azar las zonas en las que se vacunaría anualmente a unos 120.000 niños entre 2019 y 2022. Los investigadores comprobarían el éxito de la administración y compararían las tasas de malaria, meningitis y otras enfermedades, así como la mortalidad, en las áreas vacunadas y las de control.
Malawi recibiría de buen grado una vacuna eficaz. Ha experimentado progresos en la lucha contra la malaria, principalmente gracias a las mosquiteras, el diagnóstico rápido y la mejora del acceso al tratamiento. Hace 10 años, aproximadamente el 60% de los niños estaba infectado en cualquier momento dado, frente a un 17% en la actualidad. Pero Don Mathanga, director del Centro de Alerta contra la Malaria en la Universidad de Malawi, con sede en Blantyre, afirma que la actual tasa de infección no es una cifra que les "satisfaga mucho". La cifra de muertos en 2017 fue de aproximadamente 7.000 y, como en otros muchos países, el descenso se ha paralizado. “De modo que nos alegró mucho ser elegidos país piloto”, remacha Mathanga.
Vacunar a los niños ha sido fácil, pero recopilar información de seguimiento es un reto
También se alegraron muchos padres. En el Hospital Central Queen Elizabeth de Blantyre, Jaquiline Masomba, de 32 años, seca la cabeza de su hijo Edson, de tres años, con un paño. Probablemente contrajo malaria por un mosquito que se coló por un agujero de la mosquitera, explica la madre. “Nuestro medio de vida depende de la destilación de alcohol”, se lamenta Masomba. “Y nuestro negocio lleva dos semanas parado”. Mientras ella cuida a Edson. Masomba no había oído hablar de la vacuna, pero ahora dice: “Por supuesto que me gustaría ponérsela cuando esté disponible”.
Violet Wilson, de 26 años, residente en Nkuazi, una aldea del sur, explica que hace todo lo posible para evitar que su hijo de cinco meses se infecte. Tapa las grietas y los agujeros de sus paredes de ladrillo con marga para impedir que entren los mosquitos. Wilson y su hijo duermen bajo una mosquitera todas las noches. Cuenta que, si el bebé tiene fiebre, se apresura a llevarlo a la clínica. Le encantó oír que llegaba la vacuna, pero a su hijo no se la pondrán porque residen en una zona de control.
Emily Phadzula, de 30 años, que vive en Bereu, un pueblo cercano, ha tenido más suerte: a finales de abril pasado, su hija Margaret, que entonces tenía cinco meses, fue la primera niña de la aldea que recibió la vacuna. Phadzula, sentada en el umbral de su casa de cemento y sujetando firmemente a Margaret, que lleva un jersey rosa, explica que oyó hablar de la vacuna en una reunión comunitaria. “No lo dudé”, dice. “Después de haber visto sufrir tanto a mis otros hijos, me encantó que por fin esta niña pudiera estar mejor protegida”. Margaret no ha sufrido efectos secundarios, excepto una fiebre ligera, y no ha padecido malaria. Phadzula recomienda a otras madres que vacunen a sus hijos.

En septiembre, casi 35.000 niños de Malawi habían recibido al menos una dosis. Vacunar a los niños ha sido fácil, pero recopilar información de seguimiento es un reto. “En los ensayos tienes un entorno controlado. Sabes dónde están los participantes, les haces un seguimiento, y si hay cualquier problema los atiendes”, señala Bernhards Ogutu, pediatra e investigador de malaria en la Universidad de Nairobi, que participa en el programa piloto de vacunación en Kenia. “Pero en el programa piloto, en cuanto les administras la vacuna, los niños se van a su casa”.
Como primer paso de comprobación, los investigadores de Malawi han establecido un sistema de seguimiento en cuatro “hospitales centinelas” que tratan a niños vacunados y sin vacunar. Comparar los datos sobre enfermedad y mortalidad debería mostrar el impacto de la vacuna, indica el pediatra Tisu Mvalo, que participa en el Proyecto Malawi de la Universidad de Carolina del Norte en Lilongüe. “Hemos tenido que formar al personal hospitalario para que recopile estos datos. Esperamos que las cifras sean suficientemente grandes como para detectar posibles diferencias”.
Hacer un seguimiento de los niños que fallecen fuera de los hospitales es aún más difícil. “Por desgracia, todavía no tenemos un registro de fallecimientos en este país”, lamenta Mathanga. Por eso, el equipo ha establecido un nuevo sistema basado en una práctica cultural: en el Malawi rural, los jefes de aldea deben asignar un lugar para enterrar a los muertos. Los investigadores pensaron que así sabrían qué niños habían fallecido. Sin embargo, muchos de ellos son analfabetos, de modo que hubo que asignarles un ayudante. El personal de evaluación del programa piloto emplea motocicletas para visitarlos con regularidad y recoger los archivos en papel; también entrevistan a los familiares de los niños fallecidos para determinar cuál ha sido la causa más probable de la muerte, aunque estas autopsias verbales no siempre son correctas.
Por otra parte, la presión para obtener resultados crece. En abril, el comité asesor de vacunas de la OMS declaró que evaluaría cualquier impacto del Mosquirix sobre la meningitis, la malaria severa y la mortalidad, y determinaría si la vacuna puede introducirse en el resto de África, tras solo dos años, en lugar de los cuatro originalmente planeados. “La evaluación continuará, pero no queremos hacer esperar más al resto de África”, afirma David Schellenberg, que dejó la LSHTM en 2016 para incorporarse al equipo de la OMS. Otro motivo para acelerar la decisión es que GSK necesita saber si puede continuar con la producción, explica Schellenberg.

Sin embargo, queda por ver si los investigadores reunirán suficientes datos para tomar una decisión. En Kenia, el programa piloto se retrasó unos cuatro meses, al parecer porque el Gobierno estaba desbordado con la puesta en marcha de la atención sanitaria universal. En Ghana, un grupo denominado Coalición por la Independencia de Ghana Ahora pedía en mayo un boicot a la vacuna, exigiendo un programa de compensación de daños similar al estadounidense, para ayudar a quienes pudieran salir perjudicados por el Mosquirix. También eso podría causar retrasos. Es más, el descenso del número de casos de meningitis y de fallecimientos en los tres países —aun siendo una buena noticia— podría hacer que los investigadores tengan que continuar la vacunación piloto más tiempo de lo esperado para detectar diferencias estadísticamente significativas.
Aaby afirma que observar si la vacuna aumenta la mortalidad entre las niñas podría exigir también más tiempo del planeado. Le preocupa que incluso sin un veredicto claro de seguridad, la comunidad sanitaria mundial ejerza enorme presión para que la vacuna se apruebe en toda África. Pero el equipo de la OMS en Ginebra sigue confiando en que sabrá si las ventajas compensan los riesgos. “Tenemos muchas comprobaciones de la evaluación. De modo que este sistema debería conseguirlo”, asegura Hamel.
Muchos malauíes no lo dudan. “La comunidad ha dado la bienvenida a la vacuna”, afirma Kaponya después de cerrar la puerta cuando salen las dos mujeres y sus bebés recién vacunados. “El único problema que tenemos aquí es que hay personas que residen en zonas no incluidas en el programa que vienen a preguntarnos por la vacuna”.
Jop de Vrieze es periodista científico en Ámsterdam. En la información colaboró Saulos Jali desde Malawi. Este artículo está financiado por el European Journalism Center (EJC) y fue publicado en inglés en la revista Science.
Puedes seguir a PLANETA FUTURO en Twitter y Facebook e Instagram, y suscribirte aquí a nuestra newsletter.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.
Archivado En
- Malaria
- Agenda 2030
- Desarrollo África
- Fundación Bill y Melinda Gates
- OMS
- Enfermedades olvidadas
- Malawi
- Agenda Post-2015
- Enfermedades tropicales
- África meridional
- Vacunas
- África subsahariana
- Programas ONU
- Enfermedades infecciosas
- Vacunación
- África
- ONU
- Enfermedades
- Medicina preventiva
- Medicina
- Desarrollo sostenible
- Sanidad
- Salud
- Planeta Futuro




























































