El lenguaje de la comunicación entre células
Los receptores son dianas de fármacos para la hipertensión, el dolor o el asma.

El Premio Nobel de Química 2012 ha reconocido los decisivos estudios de los investigadores estadounidenses Robert J. Lefkowitz y Brian Kobilka en la identificación y caracterización de los denominados receptores acoplados a proteínas G. Estos receptores son los sensores biológicos más extendidos y versátiles (existen unos 1.000 receptores de este tipo en la especie humana), responsables en buena medida de la capacidad de nuestras células de recibir mensajes del entorno, lo que es esencial para el funcionamiento de los seres vivos. Son también la diana de numerosos fármacos utilizados para el tratamiento de la hipertensión, el dolor, el asma, y otras muchas patologías.
En este caso concreto, debo decir que a la satisfacción de todo científico cuando se reconocen los méritos de unos colegas, se suma un componente más personal, ya que conozco muy directamente a los dos premiados, desde que fui discípulo de Bob Lefkowitz durante mi estancia en Duke University (Carolina del Norte) en los años 1985 y 1986, periodo en el que Brian Kobilka también formaba parte de su laboratorio.
¿Por qué son tan importantes esos receptores? Los organismos multicelulares requieren sistemas que aseguren el funcionamiento coordinado de cada una de las células especializadas para el beneficio del conjunto. La solución evolutiva a estas necesidades de socialización celular fue el desarrollo de un lenguaje muy elaborado de comunicación, capaz no solo de captar las señales externas (particularmente a través de los sistemas de percepción sensorial como la vista o el olfato), sino de integrar la información procedente de las células vecinas y del conjunto del organismo. La extraordinaria tarea de estos procesos de coordinación de la actividad celular resulta evidente si se considera que un ser humano adulto consta de aproximadamente 80-100 millones de millones de células, de unos 300 tipos celulares distintos, agrupadas en distintos tejidos y órganos, formando entre sí una red de conexiones funcionales tan intrincada como la World Wide Web por la que nos comunicamos por Internet.
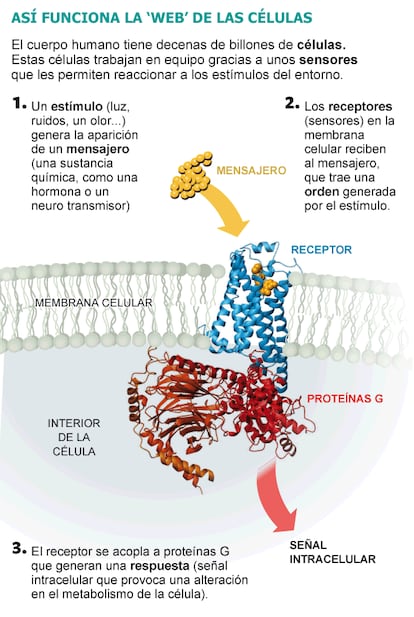
Hoy sabemos que, en general, estos sistemas de comunicación celular se organizan en relevos o en cascada, con etapas secuenciales de detección, transformación y diseminación de la señal. Unas sustancias químicas, denominadas mensajeros (también llamadas hormonas o neurotransmisores, según la función que realicen) llevan órdenes que solo son recibidas por aquellas células que poseen receptores específicos para detectarlos.
Los receptores son proteínas, frecuentemente situadas en la superficie externa de las células (la membrana celular). El reconocimiento específico del mensajero por el receptor se explica usualmente acudiendo a la analogía de la llave (mensajero) y la cerradura (receptor), aunque la realidad es un poco más compleja. El cambio de estructura espacial que experimenta el receptor cuando se une al mensajero le permite interaccionar con proteínas del interior de la célula, que generan entonces, y solo entonces, una señal intracelular, también denominada segundo mensajero. Estos modifican a su vez el metabolismo, la morfología celular o la expresión de genes, promoviendo una respuesta celular específica e integrada.
Sin embargo, cuando Lefkowitz comenzó su investigación en los años setenta, la identidad física de estos receptores y cómo transmitían señales se desconocían. Dada su formación como cardiólogo, se interesó por los receptores que responden a la adrenalina (llamados adrenérgicos), de gran relevancia en el sistema cardiovascular, ya que regulan la velocidad y la fuerza del latido del corazón, como todos experimentamos al hacer ejercicio, levantarnos bruscamente o en situaciones de alarma o estrés. Desarrolló entonces una serie de técnicas que le permitieron medir la unión de mensajeros marcados radiactivamente a membranas celulares y, posteriormente, seguir la pista y purificar las proteínas a las que esos mensajeros se pegaban.
Las células del organismo forman una red tan intrincada como la WWW
El propio Lefkowitz ha recordado en los últimos años que 1986 marcó un punto de inflexión crítico en su investigación. En efecto, entonces se dio el paso decisivo de identificar el gen que codificaba para el receptor beta-adrenérgico, uno de los receptores de la adrenalina, lo que permitió también conocer la secuencia y características de los aproximadamente 400 eslabones (aminoácidos) que componen esa proteína.
Ese proyecto lo lideraba en su laboratorio un posdoctoral de extraordinaria perseverancia y talento (también formado inicialmente como cardiólogo) llamado Brian Kobilka. Sorprendentemente, el receptor de la adrenalina presentaba notables similitudes con el receptor de la luz (la rodopsina). Al mismo tiempo, el laboratorio de Lefkowitz también descubrió que los mecanismos de regulación del receptor de adrenalina eran muy parecidos a los de la rodopsina de la retina. Se vislumbraba, por tanto, la emergencia de una familia de receptores para estímulos externos muy diversos pero que conservaban unos rasgos de funcionamiento común: estaba naciendo lo que luego resultó ser la gran familia de receptores acoplados a proteínas G. Tuve el privilegio de ser testigo de esos meses frenéticos en los que culminaron esos esfuerzos y se comenzaba a intuir su repercusión conceptual.
En los meses y años siguientes se llegarían a identificar por muchos grupos de investigación centenares de esas proteínas que, a pesar de reconocer de forma específica mensajeros diferentes (unos adrenalina, otros histamina, otros quimioquinas, o la hormona luteinizante, los opiáceos, prostaglandinas, sustancias aromáticas, etcétera) compartían una lógica funcional. Esto es, aunque la parte de reconocimiento de la llave fuese diferente, todas esas cerraduras / sensores eran marcas o variantes de un mismo diseño y estructura común, y todas eran capaces, cuando se activaban, de encender una maquinaria intracelular similar: las proteínas G, interruptores moleculares que a su vez ordenan la formación de segundos mensajeros en el interior de la célula.
Tras trasladarse a la Universidad de Stanford (California) en 1989, Kobilka se propuso un reto que tardó casi 20 años en alcanzar: dilucidar la estructura en el espacio de esos receptores. Entre 2007 y 2012 Kobilka ha conseguido imágenes de diversos receptores, y capturado recientemente uno de ellos en el estado activo (cuando está interaccionando con la proteína G), lo que permitirá aprender mucho del funcionamiento íntimo de estas proteínas.
La aplicación práctica de estos estudios radica en aprovechar la gran capacidad de control de las funciones celulares de estos sistemas para modificarlas de la forma más eficaz y específica posible. Así, pueden seleccionarse o diseñarse compuestos químicos capaces de unirse con gran afinidad a los mismos receptores que nuestros mensajeros internos, consiguiendo así mimetizar o impedir su acción. Por ejemplo, se utilizan para tratar el asma, para el tratamiento de la hipertensión, para inhibir la excesiva secreción gástrica, como analgésicos, etcétera.
El camino abierto por Lefkowitz y Kobilka, seguido actualmente por muchísimos otros investigadores, permitirá seguir conociendo mejor las alteraciones de receptores en situaciones patológicas y avanzar en el diseño de nuevas estrategias terapéuticas. Hay aún mucho trabajo por hacer y muchas preguntas por contestar.
Federico Mayor Menéndez es catedrático de Bioquímica y Biología Molecular e investigador del Centro de Biología Molecular Severo Ochoa, Universidad Autónoma de Madrid. Es el presidente de la Sociedad Española de Bioquímica y Biología Molecular.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.
Archivado En
- Nobel de Química
- Robert J. Lefkowitz
- Brian K. Kobilka
- Hipertensión arterial
- Fármacos anticolesterol
- Asma
- Premios Nobel
- Premios ciencia
- Química
- Enfermedades cardiovasculares
- Premios
- Medicamentos
- Enfermedades respiratorias
- Eventos
- Enfermedades
- Farmacia
- España
- Ciencias exactas
- Biología
- Investigación científica
- Medicina
- Ciencias naturales
- Salud
- Ciencia
- Sociedad




























































