Dos experimentos de biología sintética iluminan el camino de los futuros tratamientos contra el cáncer
Un trabajo con inmunoterapias permite que las células curativas se activen o desactiven según el progreso del cáncer y otro amplía el alcance de las exitosas terapias CAR-T a tumores como el de páncreas

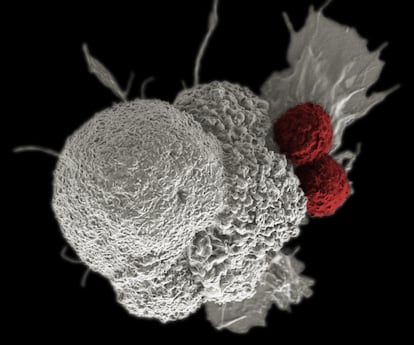
La historia de la lucha contra el cáncer es una batalla contra un enemigo interior. Las células tumorales son también nuestras y es difícil distinguirlas de las sanas, lo que explica la toxicidad de muchas terapias oncológicas. Las quimioterapias, los primeros fármacos contra el cáncer, matan a células enfermas y sanas con la esperanza de que estas salgan algo mejor paradas. Después, llegaron los tratamientos dirigidos, que buscaban bloquear la expresión de proteínas concretas, y detener así la progresión de la enfermedad. En los últimos años, inmunoterapias como las CAR-T han llevado la personalización de los tratamientos a un nuevo nivel. Estas células quiméricas se crean después de extraerle al paciente los linfocitos T (células especializadas del sistema inmune), introducirles modificaciones para que reconozcan antígenos determinados en las superficies de las células tumorales del enfermo, e inyectárselos de nuevo para que las eliminen.
Con cada avance, además de las mejoras en supervivencia, se hacen visibles las limitaciones, los efectos secundarios, o la gran capacidad del cáncer para adaptarse y burlar los tratamientos. Las CAR-T han mostrado eficacia con tumores líquidos, como la leucemia, pero no han conseguido superar las barreras inmunosupresoras que las desactivan antes de llegar a tumores sólidos como el de páncreas o el melanoma. Además, la actividad de estos tratamientos no se puede regular en el tiempo para responder a la capacidad de adaptación de las células cancerígenas. Esta semana, dos equipos científicos presentan en la revista Science soluciones que se apoyan en la biología sintética para superar algunas de estas limitaciones. De momento, esas tecnologías solo las han probado en ratones.
En uno de los trabajos, un equipo liderado por Ahmad Kalil, de la Universidad de Boston, desarrolló una serie de interruptores genéticos que se añaden a células inmunes humanas y permiten regular su actividad, haciendo, por ejemplo, que inicien su actividad antitumoral en un momento determinado, y que no actúen solo en el momento de inyectarlas en el paciente. Los científicos diseñaron el interruptor para que se active con fármacos ya aprobados y que han mostrado su seguridad, como el grazoprevir, que se utiliza para tratar la hepatitis C, el afimoxifeno, empleado para el cáncer de mama, o el ácido abscísico, una hormona presente en las plantas.
“La batalla entre los tumores y las células inmunes es cambiante y ahora mismo los linfocitos T no son capaces de adaptarse para derrotar al tumor”Emanuel Salazar-Cavazos, Instituto Nacional del Cáncer de EE UU
“La batalla entre los tumores y las células inmunes es cambiante y ahora mismo los linfocitos T no son capaces de adaptarse para derrotar al tumor”, apunta Emanuel Salazar-Cavazos, investigador mexicano del Laboratorio de Inmunología Integrativa del Cáncer del Instituto Nacional del Cáncer en Bethesda (EE UU) y coautor de un análisis que también publica hoy Science sobre los nuevos hallazgos. “En un momento dado, si se toma una muestra y ves que esos linfocitos T están perdiendo la batalla, podrías modificar algunos genes para regular una función que nos permita contrarrestar los mecanismos que esté empleando la célula tumoral para evadir al sistema inmune”, continúa.
Esta tecnología permitiría que inmunoterapias como los CAR-T se fuesen adaptando a una enfermedad tan dinámica como el cáncer. Grégoire Altan-Bonnet, líder del equipo en el que trabaja Salazar, apunta que “estas células se podrían modificar para que hubiese varias poblaciones, unas activas y otras en descanso, y se fuesen cambiando de estado para que siempre hubiese alguna activa y lista para atacar a las células tumorales”. Según explica Luis Álvarez-Vallina, director de la Unidad de Investigación Clínica en Inmunoterapia del Cáncer del Hospital 12 de Octubre y el Centro Nacional de Investigaciones Oncológicas (CNIO) de Madrid, esta combinación de apagados y encendidos permitiría evitar “que los linfocitos entren en agotamiento, algo que sucede cuando actúan de forma continuada”. Además, según indica este investigador, sería posible desactivar los CAR-T si se ve que el paciente se está intoxicando o potenciar su actividad en caso de necesidad.
En el segundo trabajo, un equipo liderado por Wendell Lim, de la Universidad de California, en San Francisco (EE UU), empleó unos receptores sintéticos para añadirlos a los CAR-T y así afinar el momento del ataque de los linfocitos mejorados. Ese nuevo punto de enganche sirvió para que los CAR-T produjesen interleuquina 2, una proteína que desencadena el ataque inmunitario, pero solo cuando hubiese contacto directo con las células tumorales. Por un lado, esta tecnología redujo los daños colaterales del bombardeo inmunológico, y por otro, permitió superar el entorno inmunosupresor que protege a los tumores sólidos y redujo su tamaño en los ratones que sirven como modelo.
Ensayos clínicos próximos
La combinación de estas técnicas, si al final también funcionan en humanos, será una forma de adaptar las terapias a una enfermedad tan dinámica como el cáncer, manteniendo la actividad inmune a lo largo del tiempo, intensificándola cuando haya necesidad y dirigiéndola solo a los puntos donde se dañe el tumor sin herir al paciente. Lim explica que ya están “planeando utilizar esta tecnología en ensayos clínicos” y preparándose para “intentar empezar en uno o dos años”. Kalil apunta que aún no han llevado la tecnología a ensayos con humanos, pero que planean hacerlo en el futuro y que hay compañías biotecnológicas que también están desarrollando tecnologías similares para llevarlas al mercado. Wilson Wong, uno de los coautores del estudio, es cofundador de Senti Biosciences, una de esas compañías.
Además de los problemas técnicos, para que este tipo de tratamientos lleguen a muchas personas, deberán superar el coste de producirlos. Ahora, las terapias con CAR-T cuestan cientos de miles de euros y la incorporación de la biología sintética no los va a abaratar a corto plazo. A la larga, según comenta Altan-Bonnet, podría hacerlo: “Uno de los grandes problemas de los CAR-T es que tienes que hacer muchos, porque tienen una actividad débil. Con la tecnología que hemos visto en estos artículos se podría mejorar la calidad y, quizá, no se necesitaría producir tantos y eso abarataría el proceso”.
Como se observó durante la crisis del coronavirus, la acumulación de conocimiento y la posibilidad de combinar disciplinas en la búsqueda de soluciones médicas, puede alcanzar en años objetivos que antes requerían décadas. Entonces, una tecnología como la del ARN mensajero, diseñada como vacuna para el cáncer, se pudo reorientar a combatir una pandemia. Los inmunólogos pueden sumar sus esfuerzos al de físicos que elaboran modelos que ahorran tiempo de pruebas de nuevas tecnologías o a las inteligencias artificiales para acortar el tiempo que hay entre un ensayo con ratones de laboratorio y el uso en humanos. En este caso, Khalil explica que la ingeniería de células inmunitarias puede ayudar a “tratar enfermedades autoinmunes” y la posibilidad de elegir cuándo se activa un medicamento que ya está dentro del paciente tiene potencial para mejorar terapias génicas frente a enfermedades hormonales o del hígado. Para Lim, además de destacar las posibilidades que ofrece la liberación de interleuquina 2 localizada en otros tumores sólidos, el uso de células para transportar terapias “puede ser útil en enfermedades autoinmunes, neuroinflamatorias y fibrosis”.
Álvarez-Vallina cree que este tipo de tecnologías llegarán “relativamente rápido” a los enfermos comunes, “con estas tecnologías de biología sintética u otros similares” porque “las terapias CAR-T funcionan relativamente bien, pero tienen limitaciones como las toxicidades o su aplicación a tumores sólidos”. No obstante, no ve probable que estas terapias celulares avanzadas vayan a sustituir totalmente los fármacos que se utilizan hoy, como la quimioterapia o los medicamentos dirigidos. “En el futuro habrá un tratamiento cada vez más personalizado y se incorporarán las nuevas tecnologías, pero tendrá mucha importancia la combinación de agentes, también de los que utilizamos ahora”, concluye.
Puedes seguir a MATERIA en Facebook, Twitter e Instagram, o apuntarte aquí para recibir nuestra newsletter semanal.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.




























































