El ‘diálogo’ entre plaquetas y leucocitos lanza la respuesta inmune
Un grupo del CNIC describe por vez primera el lenguaje molecular que emplean los glóbulos blancos para activar la defensa frente a los patógenos
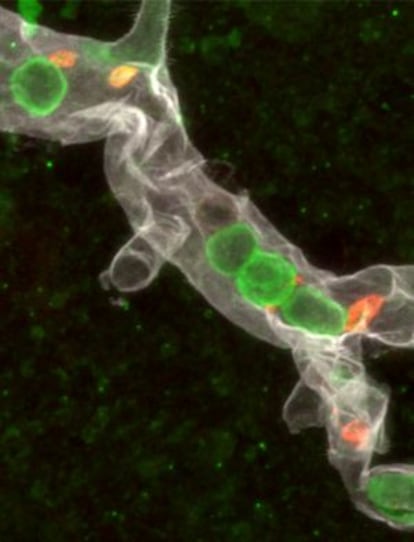
¿Qué sucede en los primeros momentos de la inflamación de un tejido? ¿Cómo se desencadena la respuesta inmune? Un grupo del Centro Nacional de Investigaciones Cardiovasculares (CNIC) ha descrito por vez primera el lenguaje molecular que emplean los glóbulos blancos más comunes (los neutrófilos) con las plaquetas para activar la respuesta defensiva del cuerpo. Es una comunicación clave: de esta conversación depende la inflamación de los tejidos, que se inicia como respuesta a las agresiones, y que está en la raíz de enfermedades como el ictus, el cáncer o la diabetes. De ahí la importancia del hallazgo, que publica Science, y el interés por describir el proceso.
Los neutrófilos (un tipo de leucocitos o glóbulos blancos) son las células de la sangre sobre las que descansa la responsabilidad principal de la respuesta ante las agresiones de patógenos. También son quienes dan la orden de iniciar la inflamación que se activa ante una lesión, ya sea un corte o una infección bacteriana. Este papel ya se conocía, pero no es lo mismo saberlo que poder reconstruirlo al detalle, incluso con imágenes de alta resolución, como ha hecho el equipo de Hidalgo, lo que abre las vías de nuevos tratamientos frente a las enfermedades ligadas a la inflamación crónica. “[La relación entre respuesta inmune, inflamación y enfermedad] es algo que el doctor Fuster siempre tiene muy presente”, explica el principal responsable del trabajo, Andrés Hidalgo, investigador del CNIC, en referencia al cardiólogo Valentín Fuster, director general del centro.
Los investigadores del CNIC han advertido que los neutrófilos, que fluyen con la sangre por toda la red vascular, se adhieren a las paredes de los vasos en los que se ha activado una primera sospecha de agresión. Al entrar en contacto con las paredes de los vasos alteran su forma redondeada, se aplanan, se fijan a los capilares y despliegan lo que Hidalgo describe como una “antena celular” que se introduce en el flujo sanguíneo con una misión: detectar plaquetas activadas.
Las plaquetas son las células sanguíneas especializadas en frenar las hemorragias, y acuden allí donde hay sangrados; pero también donde, por ejemplo, se producen infecciones bacterianas. La antena de los leucocitos –en realidad una protrusión celular que se adentra hacia el interior del vaso- cuenta en su extremo con una proteína (PSGL-1) capaz de detectar a las plaquetas que han activado su función de alerta y fijarlas gracias a sus propiedades adhesivas. Es una especie de anzuelo lanzado al torrente sanguíneo. Si pican plaquetas activadas (y se pegan a la proteína gracias a un ligando) significa que algo va mal, y así lo interpretan los leucocitos que, inmediatamente activan la señal de alarma y desencadenan la respuesta inmune a gran escala. Hidalgo lo explica de otra forma: los neutrófilos son policías que interrogan a la sangre hasta que detectan un número suficiente de plaquetas, momento en el que deducen que algo va mal. Los investigadores han advertido, además, que los leucocitos escupen ADN como parte de su acción defensiva, a modo de red bactericida, ya que la molécula de la doble hélice tiene propiedades antibacterianas.
Los hallazgos que describe el equipo de Hidalgo parten de inducir procesos inflamatorios en ratones y registrar la reacción de los leucocitos y las plaquetas con potentes técnicas de imagen (microscopía intravital) que permiten observar procesos biológicos en animales vivos. Son métodos que exigen cirugía abierta, por lo que no se pueden aplicar en humanos. Pero dado que las estructuras celulares (los leucocitos y las plaquetas) y moleculares (las proteínas y sus ligandos) están presentes también en el sistema inmune de las personas, las conclusiones, explica el investigador, son trasladables a los humanos.
¿Qué aplicaciones clínicas pueden surgir de estos descubrimientos? Los investigadores han observado cómo la respuesta inflamatoria, cuando se descontrola, da a lugar a patologías como el ictus. Uno de los modelos que han analizado son ratones con este tipo de accidentes vasculares. En estos casos, los leucocitos reaccionan en exceso a las plaquetas, por lo que la inflamación provoca daño en los vasos, lo que deriva en coágulos.
Conocer al detalle cómo se desencadenan la serie de acontecimientos a nivel celular y molecular de la activación de los neutrófilos aumenta el número de dianas a atacar para combatir los efectos colaterales de la inflamación. Ahora hay fórmulas que cortan esta cadena de acontecimientos, pero de forma muy poco sutil. Un ejemplo de ello es la aspirina, que se ha administrado tradicionalmente a enfermos con riesgo de trombosis para reducir la presencia de plaquetas en sangre. A menor número de plaquetas, menor activación de leucocitos, menos inflamación y riesgo de trombos. Pero lo que se gana al evitar la formación de coágulos se pierde con un mayor riesgo de hemorragias. “Las plaquetas son esenciales para el correcto funcionamiento del engranaje inflamatorio”, apunta Hidalgo.
Saber cómo funciona el circuito de la activación del sistema inmune permite ser más selectivos y atacar directamente, por ejemplo, a la molécula que detecta las plaquetas en los leucocitos. En pacientes con inflamación crónica y riesgo de desarrollar enfermedades asociadas, por ejemplo, se podría modular la actividad del anzuelo (el PSGL-1), sin interferir en el resto de funciones de los leucocitos ni afectar a la presencia de plaquetas. Aunque, de momento, las aplicaciones que se pueden derivar del artículo quedan aún lejos de la clínica.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.




























































