Destellos brillantes y ultracortos iluminarán la nueva biología estructural
Los láseres de rayos X abren paso a la cristalografía sin cristales
La observación directa del mundo que nos rodea revela claramente que los materiales componentes de los seres vivos son distintos de los materiales que integran el mundo inerte. De modo simplista se puede decir que los materiales inertes son duros como piedras mientras que los materiales biológicos son delicados como flores. Naturalmente, ambos materiales están hechos de átomos, participando de aquella visión filosófica de los atomistas griegos (Demócrito de Abdera, 460-370 A.C.) sustanciada por la ciencia moderna. Las fuerzas naturales han seleccionado distintos átomos componentes y distintas estructuras moleculares para cada uno de los dominios distintos de la naturaleza.
Los avances científicos del siglo pasado han establecido, sin lugar a dudas, que los organismos vivos se rigen por las mismas leyes físico-químicas que la materia inerte, empezando con la química de los compuestos orgánicos más simples, la bioquímica y fisiología después, y terminando con la estructura del ADN, el código genético y la secuencia del genoma humano en las últimas décadas del siglo XX. La biología estructural actual ha revelado el sutil entramado atómico, encaje de bolillos y bordado atómico, que constituyen las formas y estructuras de las moléculas que hacen posible la vida. El banco de datos de proteínas (Protein Data Bank) contiene ahora más de 60.000 estructuras moleculares, obtenidas laboriosamente por laboratorios en todo el mundo en los últimos 50 años desde que se revelaron las estructuras de las primeras proteínas: hemoglobina y míoglobina.
Los grandes sincrotrones de tercera generación parecían ser las ultimas linternas mágicas para iluminar la materia y arrancar sus secretos estructurales
Estos resultados tan espectaculares son el logro de los artesanos manuales de la ciencia, los héroes anónimos que por un momento han subido al escenario
La gran mayoría (más del 95%) de este catálogo de estructuras moleculares se ha obtenido gracias al método de la difracción de rayos X en cristales formados por las moléculas integrantes; una metodología que ha dado sus resultados más espectaculares con el uso de los sincrotrones. Estas instalaciones científicas se han propagado por todo el mundo aumentando la capacidad de la biología estructural de una forma inimaginable hace solo unas décadas. Los grandes sincrotrones de la tercera generación (ESRF en Francia; Spring8 en Japón; APS en Estados Unidos) parecían ser las ultimas linternas mágicas para iluminar la materia y arrancar sus secretos estructurales.
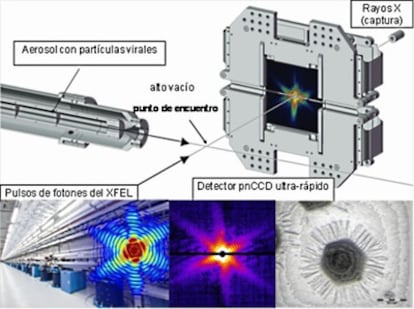
Una vez más, nunca se debe subestimar la capacidad de la curiosidad, pasión e imaginación humanas para sobrepasar los límites. Las nuevas fuentes de rayos X, conocidas como láseres de electrones libres (XFEL) tienen unas características técnicas que permiten iluminar e interrogar de una forma singular y nueva a la materia que nos rodea y en particular a las moléculas que forman parte de los seres vivos. Incluso en relación con los sincrotrones de la tercera generación mencionados antes, la intensidad de los XFEL es espectacular. El Linac Coherent Light Source (LCLS), cerca del campus de la Universidad de Stanford en California, es el primer laser de rayos X y en la actualidad la fuente más brillante del mundo. El termino brillante (brilliant) se refiere en este caso al número de fotones por unidad de tiempo, de área, de ángulo, de paso de longitud de onda de la radiación (fotons/s/mm2/mrad2/0.1%BandWidth) .
Los pulsos delLCLS exceden en brillo a los de los sincrotrones convencionales de la tercera generación en un factor de 10.000 millones (10 elevado a la novena potencia).Por comparación, toda la energía contenida en un pulso aislado del LCLS enfocado en una milésima de milímetro cuadrado de superficie sería equivalente a la energía total de la radiación solar concentrada en un milímetro cuadrado.
Desaparecen en billonésimas de segundo
Naturalmente, esto implica una limitación: la energía es tal que los materiales expuestos se vaporizan en billonésimas de segundo. Sin embargo, la coherencia, es decir, la homogeneidad en tiempo (o fase) y el paralelismo de los rayos X producidos por estas nuevas fuentes es espectacular, permitiendo ver efectos de difracción de una sola molécula. No hay necesidad de empaquetar billones de moléculas en un cristal para aumentar la señal de la difracción y disminuir el ruido debido a las imperfecciones de la red cristalina y las variaciones de moléculas integrantes. Son estas las propiedades que singularizan a los XFEL como algo único en la segunda década de nuestro siglo.
¿Cómo explotar estas propiedades para interrogar a la naturaleza con experimentos inteligentes? ¿Sería posible exponer muestras de moléculas biológicas y obtener información sin vaporizarlas antes: difracción sin destrucción? Responder a estas preguntas requiere unos dispositivos experimentales extremadamente complejos, intrincados, que además han de coordinarse con los pulsos extremadamente cortos (femtosegundos) de rayos X emitidos por los XFEL. Entre otras muchas sutilezas experimentales que los espectaculares trabajos de Janos Hajdu y Henry Chapman (y la multitud de colaboradores internacionales) han tenido que resolver figura en primera fila el dispositivo experimental necesario para exponer las muestras biológicas por una fracción pequeñísima de tiempo a los intensos rayos X. Los dos equipos multinacionales han resuelto el problema de dos formas análogas para dos tipos de muestras biológicas distintas. De este modo han abierto el camino para dos formas nuevas de estudiar los materiales biológicos.
En los experimentos de difracción llevado a cabo sin cristales, las partículas víricas individuales de mimivirus (el virus más grande que se conoce) fueron inyectadas en una suspensión gaseosa (aerosol) en una dirección perpendicular a la trayectoria de los rayos X emitidos por el XFEL. Cuando los fotones encontraron a una partícula en su camino, la difracción fue recogida por el detector ultra-rápido colocado detrás. El análisis computacional de estas imágenes permite la reconstrucción de la estructura de la partícula viral.
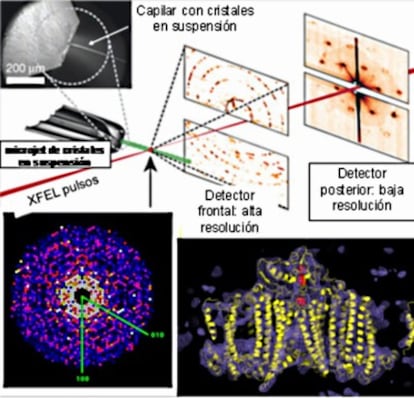
Los experimentos del grupo de Chapman y sus colaboradores tenían como objeto reconstruir la estructura tridimensional del complejo proteínico llamado Fotosistema I (PS-I, involucrado en la fotosíntesis en las plantas) a partir de datos obtenidos de cristales de dimensiones del orden de billonésimas de metro (nanocristales). Al ser los cristales tan pequeños solo podrían contener en su interior un número muy pequeño de moléculas ordenadas en la red cristalina. En este caso, el dispositivo experimental fue crear un flujo de cristales en una disolución tampón moviéndose uniformemente a 10 metros por segundo en un capilar, también en dirección perpendicular a los rayos X. Los patrones de difracción producidos cuando la radiación encontraba un nanocristal en su camino (aproximadamente 15.000) fueron procesados y permitieron reconstruir la estructura de la proteína PS-I a 8.5 Å de resolución.
Estos logros tan espectaculares no son el resultado de las grandes mentes teóricas de la ciencia actual. No. Son el logro de los artesanos manuales de la ciencia. Los héroes anónimos que por un momento han subido al escenario. Ellos son los que han diseñado, creado y han demostrado como usar un icono monumental comparable a las grandes catedrales medievales, pero en el dominio de la instrumentación científica.
La curiosidad e imaginación de la comunidad internacional de físicos, instrumentalistas, especialistas de sincrotrones y biólogos estructurales ha abierto una ventana para explorar las sutilezas estructurales y atómicas del mundo que nos rodea. Es un buen augurio para las décadas venideras de nuestro siglo de que la biología estructural continua viva y vibrante. Esperemos que estos descubrimientos redunden de una forma directa o indirecta en beneficio de la humanidad.
Cele Abad-Zapatero es profesor adjunto en la Universidad de Illinois en Chicago y autor de Crystals and Life (IUL, 2002). En la actualidad está de profesor visitante en la Universidad y en el Parque Científico de Barcelona. Su web
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.




























































