Así consigue un laboratorio multiplicar por 1.000 el precio de un medicamento
Leadiant Biosciences ha subido de 14 céntimos a 140 euros la pastilla del tratamiento de una enfermedad rara aprovechándose del monopolio concedido por la UE

Para la
enfermedad
rara (XCT)
Para enfermos
de cálculo biliar
40.000 personas
por cada millón
1 persona por
cada millón

Para la
enfermedad
rara XCT
Para enfermos
de cálculo biliar
40.000 personas por cada millón
1 persona por
cada millón
El ácido quenodesoxicólico ( ) llevaba en 2011 más de 30 años en el mercado para el tratamiento de algunos tipos de cálculos biliares. La caja de 48 cápsulas costaba 6,96 euros (14 céntimos cada una). Desde finales de los años noventa, además, el fármaco también se había empezado a utilizar fuera de indicación para una enfermedad genética muy rara y grave, la xantomatosis cerebrotendinosa (XCT), que causa un deterioro neurológico que puede ser mortal.
) llevaba en 2011 más de 30 años en el mercado para el tratamiento de algunos tipos de cálculos biliares. La caja de 48 cápsulas costaba 6,96 euros (14 céntimos cada una). Desde finales de los años noventa, además, el fármaco también se había empezado a utilizar fuera de indicación para una enfermedad genética muy rara y grave, la xantomatosis cerebrotendinosa (XCT), que causa un deterioro neurológico que puede ser mortal.
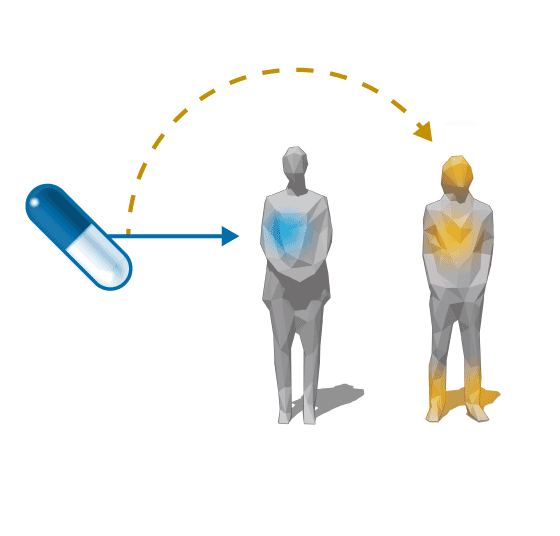
Fuera de
indicación
0,14
euros
Ácido
quenodesoxicólico
(AQ)
Cálculo
biliar
Enfermedad
rara XCT
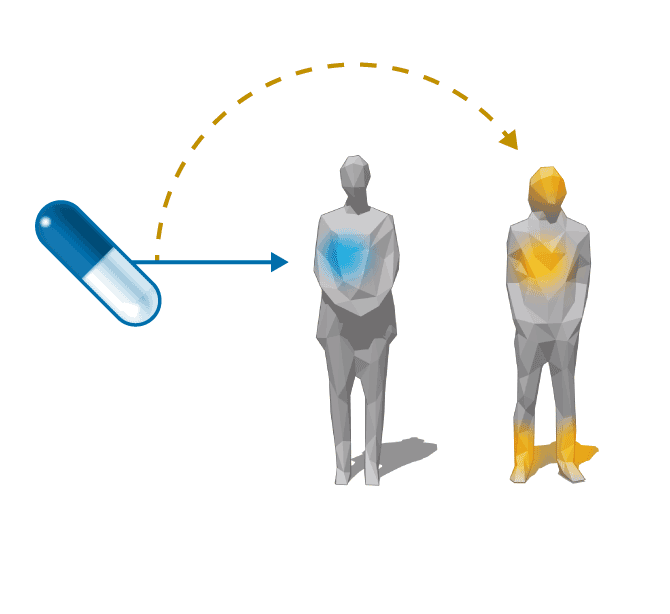
Fuera de
indicación
0,14
euros
Ácido
quenodesoxicólico
(AQ)
Cálculo
biliar
Enfermedad
rara XCT
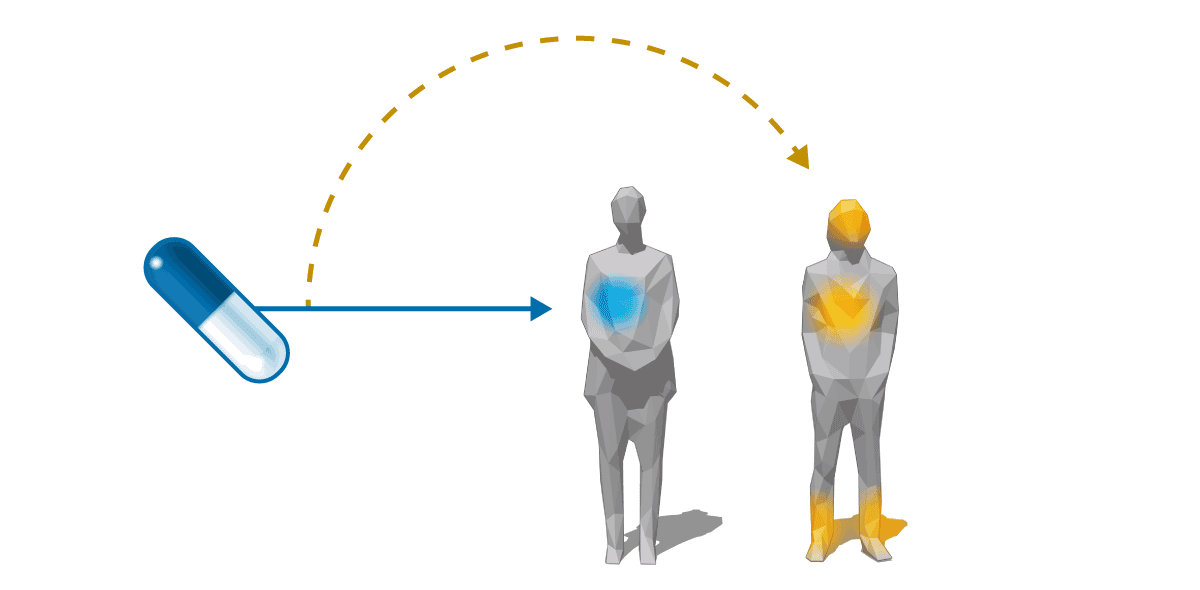
Tratamiento
fuera de indicación
0,14
euros
Cálculo
biliar
Enfermedad
rara XCT
Ácido
quenodesoxicólico
(AQ)
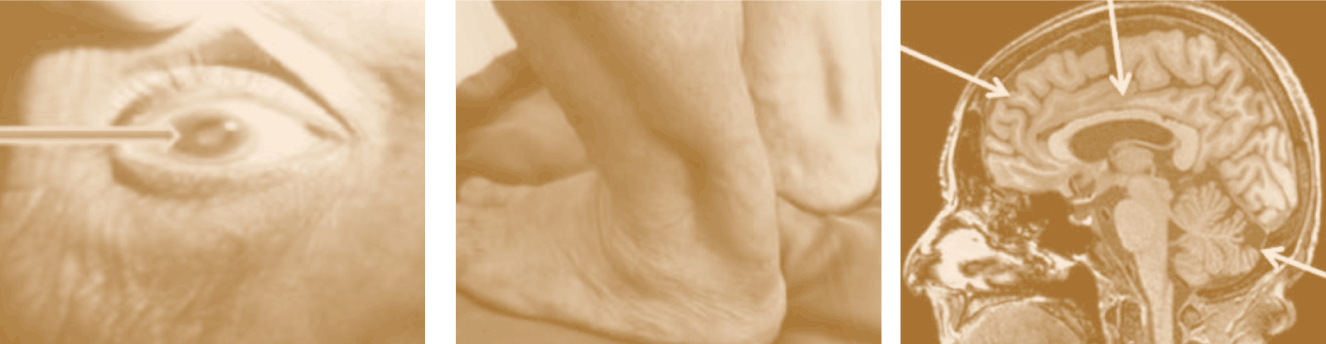
Los síntomas de la XCT pueden incluir diarrea, cataratas, problemas de los tendones, y problemas neurológicos progresivos.
Paula Pérez-Torre, del servicio de Neurología del Hospital Ramón y Cajal (Madrid), calcula que en España hay entre 40 y 50 afectados por XCT, aunque es una “enfermedad infradiagnosticada y puede haber más”.
Los cálculos biliares que trataba el AQ ( )
son una dolencia común que llega a afectar a un 4% de la población, aunque la mayoría no desarrollará síntomas (dolor intenso, inflamación...). Pero el avance de técnicas quirúrgicas poco invasivas (como la laparoscopia) y otros fármacos con menos efectos secundarios (como el ácido ursodesoxicólico) dejaron anticuado el AQ (
)
son una dolencia común que llega a afectar a un 4% de la población, aunque la mayoría no desarrollará síntomas (dolor intenso, inflamación...). Pero el avance de técnicas quirúrgicas poco invasivas (como la laparoscopia) y otros fármacos con menos efectos secundarios (como el ácido ursodesoxicólico) dejaron anticuado el AQ ( ), según Lucas Ilzarbe, médico adjunto del servicio del Aparato Digestivo del Hospital del Mar (Barcelona).
), según Lucas Ilzarbe, médico adjunto del servicio del Aparato Digestivo del Hospital del Mar (Barcelona).
Ácido
ursodeso-
xicólico
Ácido
quenodeso-
xicólico (AQ)
Cirugía
0,14
euros
Enfermos de
cálculo biliar
Enfermedad
rara (XCT)
Ácido
ursodeso-
xicólico
Ácido
quenodeso-
xicólico (AQ)
Cirugía
0,14
euros
Enfermos de
cálculo biliar
Enfermedad
rara (XCT)
Ácido
ursodesoxicólico
Ácido
quenodesoxicólico (AQ)
Cirugía
0,14
euros
Enfermos de cálculo biliar
Enfermedad
rara (XCT)
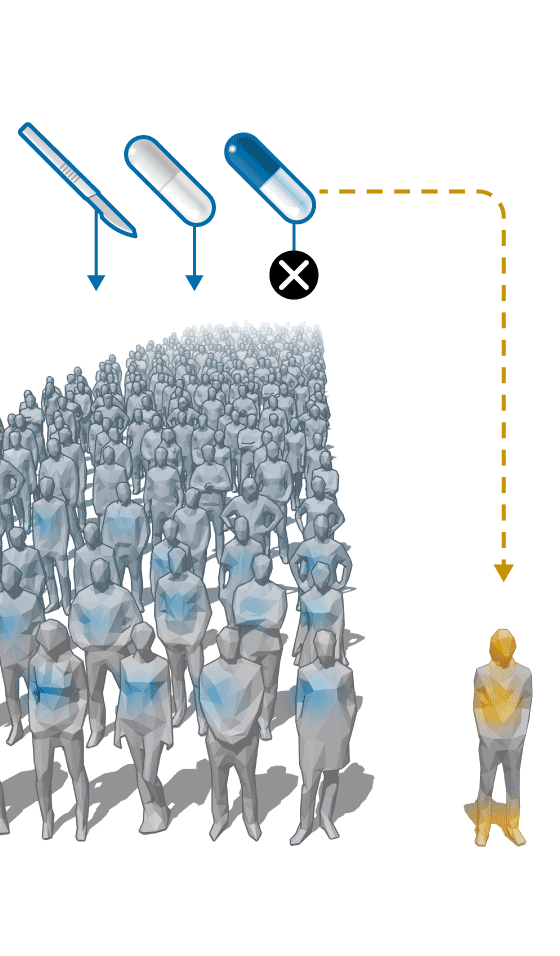
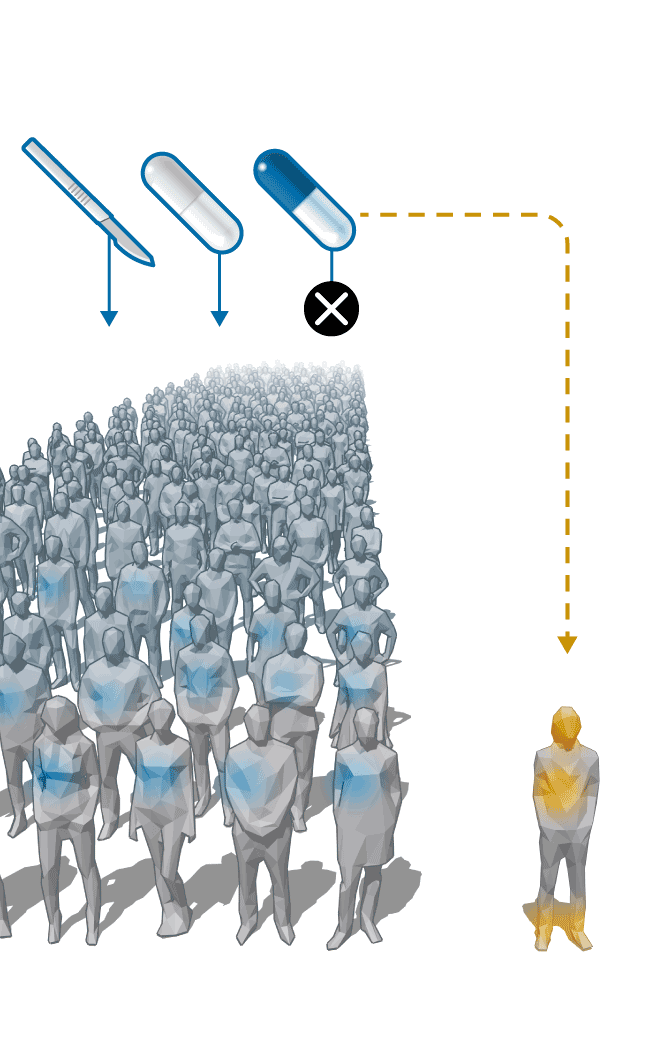
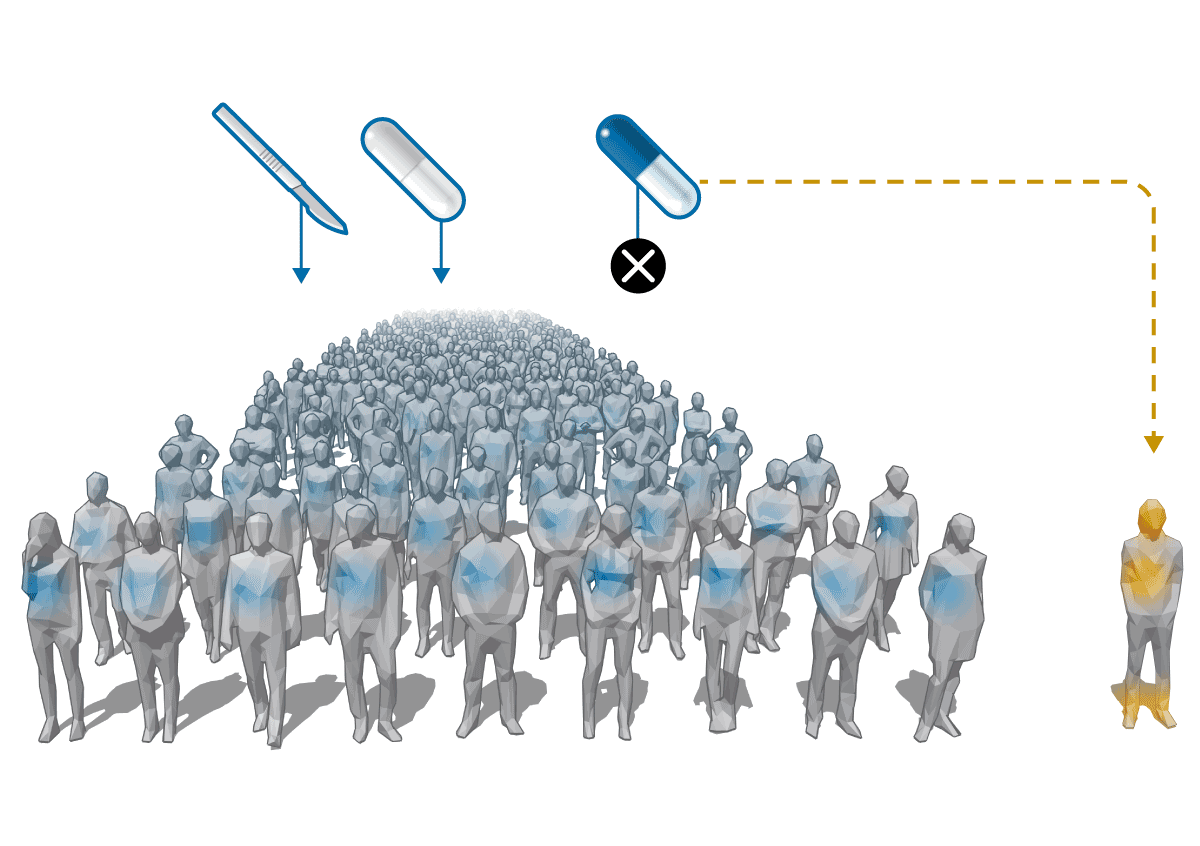
Esta es la razón que hizo que el AQ ( ) se fuera abandonando progresivamente como tratamiento de los cálculos y quedara solo como terapia frente a la XCT.
) se fuera abandonando progresivamente como tratamiento de los cálculos y quedara solo como terapia frente a la XCT.
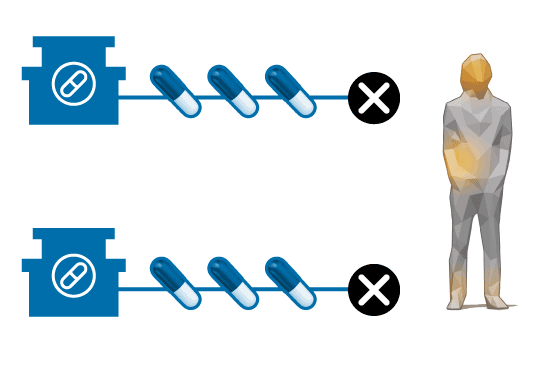
Laboratorio Zambón
XCT
Laboratorios Estedi
Pero debido a la escasa demanda y bajo precio, el AQ pierde interés para los laboratorios. Zambon, que lo vendía con la marca Quenocol, deja de hacerlo en 2001. Estedi aguanta una década más con el Quenobilan. “No llegábamos casi ni a cubrir los costes”, recuerda Álvaro Calzada, gerente de Estedi. “La política de medicamentos no considerados innovadores en España solo busca que los precios bajen una y otra vez. Esto tiene el grave problema de que no se asegura la viabilidad económica de algunos fármacos que es interesante que sigan en el mercado”, critica. En 2010, sólo se vendieron 2.411 cajas de Quenobilan, según la consultora Iqvia. Tras esta retirada, los enfermos de XCT se quedan sin tratamiento y son los servicios de farmacia hospitalaria los que tienen que producirlo.
Fármaco
huérfano
Leadiant
XCT
La situación se repite en toda Europa. En la mayoría de los países, son los fabricantes locales los que van dejando de producir el AQ por razones económicas. Pero una empresa llamada Leadiant Biosciences (Sigma-Tau Pharmaceuticals hasta febrero de 2017) entra en escena y compra las licencias de los medicamentos con AQ que aún siguen en el mercado en lugares como en Bélgica y Holanda. Con estos movimientos, Leadiant consigue quedarse como único titular del AQ en Europa.
La compañía da otro paso que le permite consolidar la situación de monopolio. Entre 2014 y 2017, logra que la Agencia Europea del Medicamento (EMA) declare el AQ como “fármaco huérfano” y que la Comisión Europea le conceda la autorización para comercializarlo para el tratamiento de la XCT en exclusiva hasta 2027. Esto hace que los hospitales ya no puedan producirlo.

Cálculo biliar
Enfermedad
rara (XCT)
Conseguido el monopolio, Leadiant Biosciences empieza a exigir 14.000 euros a los gobiernos por cada caja del medicamento.

140 euros
la pastilla
420 euros
el tratamiento
diario de
3 pastillas

153.300 euros el
coste de un solo
paciente en un año
(1.095 pastillas)

153.300 euros el
coste de un solo
paciente en un año
(1.095 pastillas)
España se opone al incremento de precio y trata de negociar desde 2017 un descuento. En octubre de 2020 sigue sin haber acuerdo y la Comisión Interministerial de Precios de los Medicamentos (CIPM), el órgano que debe dar el visto bueno a la financiación pública de los fármacos, rechaza regularizar el precio del fármaco impuesto por el laboratorio.
Con respecto a este medicamento, la Comisión acuerda proponer a la Dirección General la no inclusión del medicamento en la prestación farmacéutica del SNS ya que es un medicamento clásico para el que no se ha justificado el precio propuesto y genera un elevado impacto presupuestario.Comisión Interministerial de Precios de los Medicamentos
Pero mientras duran las negociaciones, Sanidad debe acceder a las pretensiones de Leadiant “por la necesidad de ofrecer un tratamiento a los pacientes”. Como no hay un acuerdo, la compra se hace por la vía de “situaciones especiales”. En 2020, la sanidad pública se gasta 6,6 millones en las pastillas que necesitan una cuarentena de enfermos. Hace 10 años, el coste hubiera sido de apenas 6.600 euros. Sanidad lleva el caso a Competencia y ha conseguido ahora un descuento del 72%, que entrará en vigor este diciembre. La CIPM acordó por ello financiar finalmente el Ácido Quenodesoxicólico Leadiant en la sesión del pasado 30 de septiembre. El precio oficial sigue siendo de 140 euros la pastilla, pero con el descuento el precio real es de 39,2 euros. Aun así, sigue siendo 280 veces más caro que en 2011 y el coste anual por paciente asciende a casi 43.000 euros.

Leadiant Biosciences ha recibido numerosas denuncias en Europa por prácticas abusivas por estos hechos. En Países Bajos, el organismo que regula la competencia le ha impuesto una multa de 19,1 millones de euros. En España, Competencia abrió en diciembre de 2020 una investigación tras una denuncia de la Organización de Consumidores y Usuarios (OCU) a la que se ha sumado la información remitida por Sanidad.
El ministerio autorizó en 2008 que Estedi dejara de fabricar el ácido quenodesoxicólico, un paso preceptivo cuando un medicamento va a desaparecer del mercado. La razón es que su indicación oficial era el tratamiento de cálculos biliares, para lo que ya había mejores alternativas terapéuticas.
José Luis Poveda, coordinador del Grupo de Trabajo de Enfermedades Raras y Medicamentos Huérfanos de la Sociedad Española de Farmacia Hospitalaria (OrPhar-SEFH) considera que “el sistema debe hacer una reflexión sobre cómo es posible que una formulación química ya conocida y muy barata de producir acabe por tener estos costes para el sistema”.
“El marco regulatorio debe garantizar al paciente el acceso a medicamentos con un balance riesgo-beneficio favorable. Y los acuerdos de financiación deben recompensar la inversión hecha en tecnología y ensayos clínicos para generar evidencia. Lo que no parece razonable es que haya compañías que puedan aprovecharse de los marcos jurídicos en beneficio propio”, añade Poveda.
Para conseguir la calificación de medicamento huérfano para el tratamiento de la XCT, Leadiant no presentó en 2014 ensayos clínicos impulsados por la compañía, sino que recurrió a estudios ya publicados en la literatura científica, según la información oficial de la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés). Tampoco los ha realizado hasta la fecha y el único trabajo publicado es un pequeño estudio de tipo observacional, que tiene un coste mucho menor que los ensayos.
Ángel María Martín, exjefe de Farmacia del Servicio de Salud de Castilla-La Mancha y hoy miembro de la Asociación para un Acceso Justo al Medicamento, considera que estas prácticas “son totalmente rechazables y las llevan a cabo algunas empresas que se aprovechan de las grietas de la legislación para apropiarse de fármacos bien conocidos y obtener beneficios millonarios sin apenas inversión”.
Leadiant Biosciences y Deco Pharma, su distribuidor en España, han declinado responder a las preguntas planteadas por EL PAÍS.
El precedente
La empresa Aspen Pharma se vio envuelta en 2018 en una controversia similar al retirar del mercado español cinco medicamentos contra el cáncer. Todos ellos carecían de alternativa terapéutica, eran baratos y llevaban muchos años en el mercado. Durante cinco años, Aspen consiguió que los hospitales se vieran obligados a comprar los fármacos en terceros países, donde la compañía había logrado imponer precios hasta 30 veces más elevados.
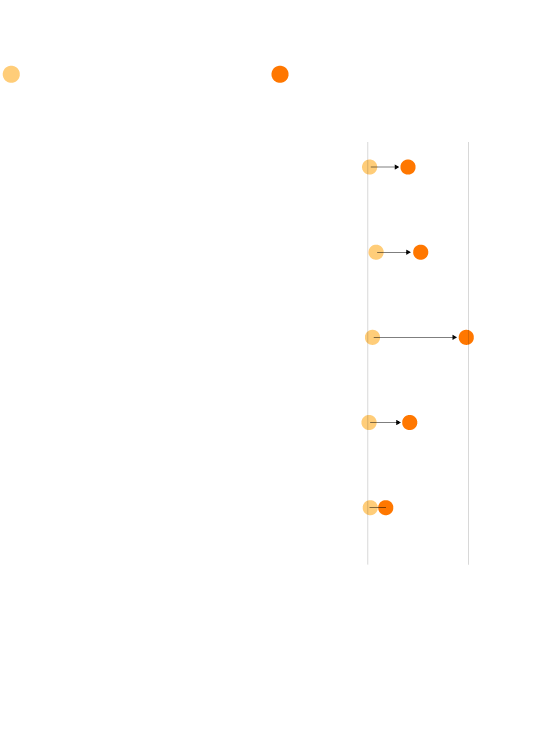
Precios de los fármacos de Aspen
Precio hasta 2014
Precio en 2018
Melfalan 2mg
5,09
99,84
50 comprimidos
Tioguanina 40mg
20,79
131,36
25 comprimidos
Busulfano 2mg
11,86
244,4
100 comprimidos
Clorambucilo 2mg
3,37
104
50 comprimidos
Mercaptopurina 50mg
6,37
44,7 *
25 comprimidos
0
250
* También vendido por Silver Pharma SL
por 41,37 euros
Fuente: Ministerio de Sanidad.

Precios de los fármacos de Aspen
Precio hasta 2014
Precio en 2018
Melfalan 2mg
5,09
99,84
50 comprimidos
Tioguanina 40mg
20,79
131,36
25 comprimidos
Busulfano 2mg
11,86
244,4
100 comprimidos
Clorambucilo 2mg
3,37
104
50 comprimidos
Mercaptopurina 50mg
6,37
44,7 *
25 comprimidos
0
250
* También vendido por Silver Pharma SL por 41,37 euros
Fuente: Ministerio de Sanidad.
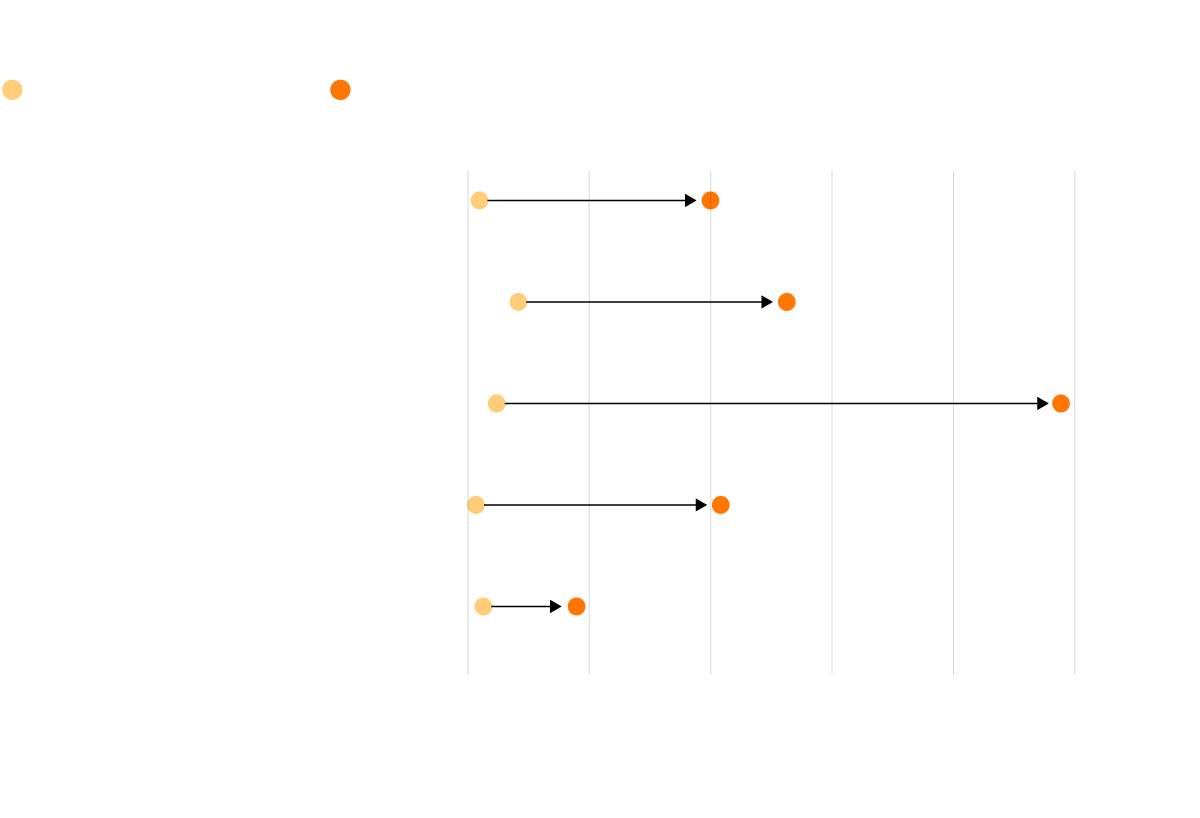
Precios de los fármacos de Aspen
Precio hasta 2014
Precio en 2018
Melfalan 2mg
5,09
99,84
50 comprimidos
Tioguanina 40mg
20,79
131,36
25 comprimidos
Busulfano 2mg
11,86
244,4
100 comprimidos
Clorambucilo 2mg
3,37
104
50 comprimidos
Mercaptopurina 50mg
6,37
44,7 *
25 comprimidos
0
50
100
150
200
250
* También vendido por Silver Pharma SL por 41,37 euros
Fuente: Ministerio de Sanidad.
El conflicto no se resolvió hasta que la Comisión Europea se implicó en el caso y sus autoridades de Competencia amenazaron a la empresa con una multa multimillonaria. Finalmente, Aspen Pharma cedió y aceptó rebajar el precio de sus fármacos un 73%. Este porcentaje es muy parecido al del descuento que ahora ha aceptado aplicar Leadiant.