Aprobado en EE UU el primer 'test' para predecir la recaída del cáncer de mama
Una nueva prueba genética para predecir si una mujer con cáncer de mama sufrirá una recaída fue aprobada la semana pasada por la agencia estadounidense del medicamento, la Food and Drug Administration (FDA), lo que representa un paso adelante hacia una era en la que los tratamientos médicos se personalizarán para cada paciente. Esta aprobación es la primera que se concede a una prueba genética tan compleja, y no sólo la primera para predecir la recaída del cáncer de mama.
Aunque hay otros tests en desarrollo o comercializados para predecir la reaparición del cáncer de mama, esta nueva prueba, conocida como MammaPrint, es la primera que ha pasado por el proceso formal de aprobación de la FDA. El organismo ha señalado su intención de supervisar más estrictamente una profusión de sofisticadas pruebas de diagnóstico que hasta ahora se han comercializado a menudo sin su aprobación.
La prueba no es del todo precisa. "No te puedes fiar totalmente de esta información", señalaba Steven Gutman, el funcionario de la FDA encargado de las pruebas de diagnóstico, en una conferencia telefónica con periodistas. Aun así, añadía, "me parece una herramienta fabulosa que debe estudiarse más".
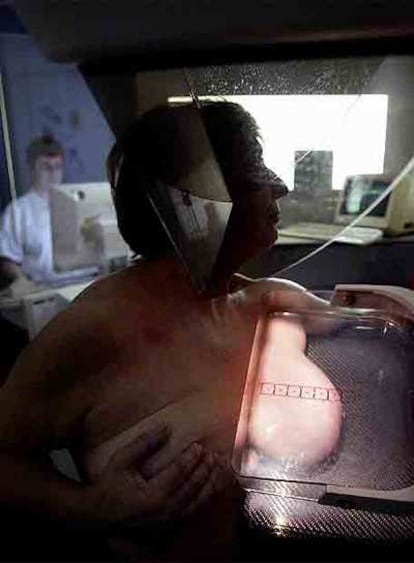
MammaPrint, desarrollada por científicos en Holanda, evalúa el patrón de actividad de 70 genes concretos en un tumor de mama una vez extirpado mediante cirugía.
Gutman dice que el 23% de las mujeres que, según esta prueba genética, tienen un alto riesgo de recaída acaban sufriendo la reaparición del cáncer en alguna parte del cuerpo en un periodo de cinco años. Sin embargo, sólo alrededor de un 5% de las que presentaban una firma genética favorable padecieron una recaída en ese periodo, comenta.
Agendia, una empresa con sede en Amsterdam que ya vende la prueba en su país y otros, se está planteando cómo ofrecérsela a los estadounidenses, comentaba su consejero delegado, Bernhard Sixt, en una entrevista. No dijo cuánto costaría la prueba.
Cada año, MammaPrint y otros tests similares pretenden ayudar a guiar el tratamiento de unas 100.000 mujeres estadounidenses que padecen un cáncer de mama que se encuentra en sus primeros estadios y no se ha extendido a los ganglios linfáticos.
Una vez extirpados los tumores, muchas de estas mujeres se someten a quimioterapia para reducir las posibilidades de reaparición del cáncer. Pero algunos estudios han demostrado que la mayoría de ellas no sufrirían una recaída aunque no se sometieran a quimioterapia. Las nuevas pruebas podrían ayudar a médicos y pacientes a decidir si algunas mujeres podrían evitar la quimioterapia y sus efectos secundarios.
"Todo el mundo está buscando maneras de averiguar quién necesita quimioterapia y quién no", afirma Clifford A. Hudis, jefe del servicio de medicina del cáncer de mama en el Memorial Sloan-Kettering Cancer Center de Nueva York. "Esto nos permite utilizar el tumor para adaptar el tratamiento a cada paciente".
Hudis es asesor de Genomic Health, una empresa de California que vende una prueba similar llamada Oncotype DX. Genomic Health trabaja según la normativa que permite ofrecer pruebas desarrolladas y llevadas a cabo en un solo laboratorio sin la aprobación de la FDA, al contrario que los equipos de pruebas que se venden de manera generalizada a laboratorios hospitalarios y consultas médicas. Estas pruebas se denominan pruebas "caseras".
Pero en septiembre, la FDA manifestó su intención de exigir una aprobación para ciertas pruebas caseras especialmente complejas: las que examinan múltiples genes o proteínas y utilizan un algoritmo para computar un resultado. El organismo ha enviado cartas a algunas empresas, entre ellas Genomic Health, en las que dice que tal vez requieran su aprobación.
La FDA celebró una sesión pública el 8 de febrero para tratar sus propuestas. Algunos fabricantes de pruebas y laboratorios clínicos dicen estar preocupados porque una regulación más estricta pueda ralentizar el desarrollo o la mejora de las pruebas. Sixt, de Agendia, señala que obtener el visto bueno de la FDA podría ayudar a cimentar la credibilidad de las pruebas. "Creo que todo el sector ganará mucha rapidez y aceptación clínica para esas pruebas", señala.
La prueba de Agendia podría suponer cierta competencia para Oncotype DX, su homóloga de Genomic Health. La prueba de Oncotype, que cuesta unos 2.700 euros, se ha utilizado en más de 21.000 pacientes durante los últimos tres años. El año pasado, la empresa realizó más de 14.500 pruebas, y duplicó así el nivel de 2005. Las grandes compañías de seguros están empezando a pagar por la prueba.
Científicos de la Universidad de Carolina del Norte y el Instituto Oncológico de Holanda analizaron 295 muestras tumorales utilizando las pruebas de Genomic Health y Agendia. Aunque las pruebas examinan genes diferentes, coincidieron en el riesgo de reaparición aproximadamente un 80% de las veces, según afirmaban los científicos en agosto en la revista médica The New England Journal of Medicine.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.




























































