La química para entender y combatir el alzhéimer
Los científicos están descifrando la estructura de las proteínas amiloides que forman las placas características de la enfermedad, paso importante para poder diseñar fármacos en el futuro
Este año se celebra el Año Internacional de la Química y de la enfermedad de alzhéimer. Es pues el momento ideal para destacar la contribución de la química al estudio de las bases moleculares de uno de los procesos claves de la enfermedad de alzhéimer: la agregación de la proteína beta-amiloide.
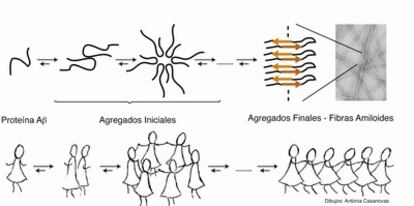
La historia empieza en 1906, cuando Alois Alzhéimer descubrió en el cerebro de Auguste Deter, enferma de lo que hoy conocemos como alzhéimer, unas acumulaciones anómalas de proteínas denominadas placas amiloides. Ochenta años más tarde se determinó que estas placas estaban formadas mayoritariamente por una proteína llamada beta-amiloide (Aß). En el cerebro de los enfermos de alzhéimer, la proteína Aß se encuentra agregada. La agregación es un proceso durante el cual una misma molécula tiene tendencia a asociarse consigo misma dando lugar a especies de mayor tamaño. En el caso de la proteína Aß, este proceso de agregación pasa por distintos intermedios formados por asociaciones de distinto número de moléculas de proteína hasta dar lugar al agregado final que se conoce como fibras amiloides. Las fibras son el componente mayoritario de las placas amiloides descritas por Alois Alzhéimer y tienen una forma similar a espaguetis. Durante los años 1985 y 1991, utilizando distintas disciplinas, se obtuvieron resultados muy alentadores que dieron lugar a la hipótesis amiloide, según la cual la agregación de la proteína Aß en forma de fibras era la causa de la enfermedad de alzhéimer.
Al formularse la hipótesis amiloide, se consideró como posible estrategia terapéutica la inhibición de la formación de fibras amiloides. Para que los químicos podamos diseñar nuevos fármacos nos es muy importante conocer la estructura, es decir, la disposición de los átomos en el espacio de la molécula que ha de interaccionar con nuestro fármaco, en este caso la fibra. En aquel momento se desconocía la estructura tridimensional de las fibras pero, afortunadamente, ya se conocían algunas de sus características estructurales globales como que las moléculas de proteína Aß se encuentran unidas entre sí mediante enlaces de hidrógeno. Nos lo podemos imaginar como si la proteína Aß fuese una persona y se dispusiera a bailar la conga. En este momento, la persona tiene dos caras: los brazos para agarrarse a una persona y la espalda donde se agarra otra. Así una misma molécula de proteína puede unirse a otras dos y estas dos a otra dos y así sucesivamente hasta formar largas estructuras fibrilares que contienen hasta 4000 moléculas de proteína. Los químicos diseñaron moléculas que reconocieran a la proteína Aß pero que sólo pudieran interaccionar con una de sus caras, y así diseñaron moléculas a las que por ejemplo les faltasen los brazos, bloqueando así la formación de fibras.
Mientras tanto, y de forma paralela a estos estudios, se iban conociendo datos que indicaban que el número de depósitos amiloides, y por lo tanto de fibras presentes en el cerebro de los enfermos de alzhéimer, no se correlacionaban con el deterioro cognitivo de los pacientes. Es aquí cuando en el 2002, la hipótesis amiloide se reformuló estableciendo que en lugar de los agregados finales (las fibras), los causantes de la enfermedad eran los agregados que se formaban en los estadios iniciales del proceso de agregación. En este sentido, los inhibidores antes desarrollados tenían que volverse a evaluar puesto que podían tener un efecto contraproducente: evitar la formación de fibras provocando la acumulación de agregados iniciales, ahora propuestos como los causantes de la enfermedad.
Para diseñar fármacos que destruyan o eviten la formación de estos agregados iniciales necesitamos conocer su estructura. Esta información es mucho más difícil de obtener para los agregados iniciales que para los finales. Los agregados iniciales tienen una naturaleza heterogénea y dinámica, es decir, son muy diferentes entre sí y cambian en función del tiempo. Podríamos comparar a los agregados finales -las fibras- con un día de Fiesta Mayor donde tocan la conga y todos la bailan en filas, mientras que compararíamos a los agregados iniciales con una concurrida discoteca donde la gente baila en grupos de dos, de tres, de seis...
Durante estos años la química está siendo decisiva en la caracterización estructural de los agregados iniciales. Por un lado nos proporciona herramientas, reacciones químicas, que permiten estabilizar los agregados iniciales: la química actúa parando la música, dejándolos congelados en una determinada posición lo que nos da más tiempo para estudiarlos. La química también nos ha proporcionado estrategias de marcaje: si mientras bailamos nos tiran confeti, dependiendo de cómo estemos dispuestos al bailar ciertas partes de nuestro cuerpo quedarán más manchadas que otras. Por ejemplo, si estamos bailando la conga el pelo y las piernas nos quedarán más manchadas de confeti que la espalda y el abdomen. La química nos permite aplicar la misma técnica a los agregados iniciales utilizando, en lugar de confeti, marcajes con distintos isótopos (átomos de un mismo elemento con distintas propiedades). De esta manera podemos conocer qué regiones de la proteína Aß son inaccesibles al confeti isotópico, lo que equivaldría a decir que son regiones más plegadas y con mayor estructura tridimensional, y qué regiones son accesibles al confeti isotópico y por lo tanto se encuentran en la superficie del agregado, y así obtener información estructural de estas formas tan relevantes en la enfermedad de alzhéimer: los agregados iniciales.
Nuestro trabajo -y el de muchos otros laboratorios- pretende avanzar significativamente en la elucidación estructural de los agregados iniciales de la proteína Aß. Cuando conozcamos detalles estructurales de estos agregados iniciales volveremos a utilizar la química para diseñar y sintetizar nuevas moléculas que o bien impidan su formación o bien modifiquen su estructura hacia formas no tóxicas para así contribuir al desarrollo de estrategias terapéuticas que permitan prevenir y curar esta devastadora enfermedad.
Natàlia Carulla es Investigadora Ramón y Cajal en el Instituto de Investigación Biomédica (IRB) de Barcelona
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.




























































