Los embriones, de uno en uno
La fecundación asistida busca la fórmula de evitar partos múltiples - La última vía investigadora persigue dar con el mejor óvulo fecundado tras estudiar su metabolismo
La primera niña probeta, la británica Louise Brown, nació el 25 de julio de 1978. Después de ella se estima que más de tres millones y medio de niños han venido al mundo gracias a las técnicas de reproducción asistida. Victoria Anna Sánchez, que nació en la clínica Dexeus, fue la número 601, y la primera española. Sólo en nuestro país, cada año se practican más de 30.000 ciclos de fecundación in vitro (FIV).
Después de todos estos años y todos estos nacimientos, nadie ha sido capaz de resolver uno de los grandes retos a los que se enfrenta la técnica: evitar los partos múltiples. Y todo, básicamente, debido a un importante problema. No existe ningún método no invasivo -sin riesgo para el embrión- que determine con certeza cuáles implantarán tras ser transferidos al útero de su madre, o incluso que permita, con criterios objetivos, clasificarlos en función de su calidad. De ahí que existan distintos grupos de investigación -uno de ellos liderado por el Instituto Valenciano de Infertilidad (IVI)- dedicados a dar con esta fórmula mágica. Y la clave, según algunos trabajos, estaría en la metabolómica, el estudio del metabolismo de los embriones.
La ley prohíbe implantar más de tres óvulos fecundados
Casi el 30% de las gestaciones de laboratorio son múltiples
Tras 30 años no se sabe con certeza si el cigoto será viable en el útero
En seis años, los nacimientos de trillizos han bajado del 4% al 1,7%
Esto no quiere decir que a lo largo de todo este tiempo no haya habido avances en la reproducción asistida. Uno de los ejemplos más claros son las mejoras alcanzadas en las tasas de éxito en las FIV, a pesar de no ser todo lo elevadas que les gustaría ni a los especialistas ni, mucho menos, a las parejas con problemas de fertilidad. Las probabilidades de quedarse embarazada han pasado del 15% o, como máximo, el 20% en el año 1984, fecha en la que nació Victoria Anna, al 40% e incluso 60% en los casos de mejor pronóstico (progenitores jóvenes, con pocos ciclos, con óvulos y espermatozoides de calidad).
También ha habido mejoras en cuestiones relacionadas con las gestaciones múltiples, especialmente en lo que se refiere a la reducción de partos de trillizos. En 2000, un 4% de los nacimientos tras una FIV eran de tres bebés, mientras que en 2006 el porcentaje bajó hasta el 1,7%, según los archivos de la Sociedad Española de Fertilidad (SEF).
Sin embargo, la cifra de embarazos múltiples en España sigue cercana al 30%, una tasa demasiado alta. Y que se traduce en mayores probabilidades de complicaciones médicas, tanto en la madre como en los bebés, que en ocasiones han de pasar por los servicios de neonatología al nacer prematuramente o con bajo peso.
La FIV consiste en fecundar los óvulos fuera del útero, sobre placas Petri de vidrio. Cuantos más óvulos se obtengan por ciclo, más se podrán fecundar y más embriones habrá para elegir y trasladar a la madre. Lo ideal sería transferir sólo uno, para lo que habría que contar con un método que, sin dañar al embrión, permitiera clasificarlos en función de su capacidad de implantación a partir de criterios objetivos. De esta forma, con sólo un óvulo fecundado habría un alto porcentaje de probabilidades de que arraigara y evolucionara hacia un embarazo.
Pero esto, de momento, no es posible. A falta de procedimientos fiables, lo habitual es seleccionar varios embriones para implantarlos en el útero. Así, es más fácil que al menos uno se desarrolle hasta el final. La ley española fija un máximo de tres, aunque la tendencia es transferir dos e incluso uno si hay buen pronóstico. Los datos de la SEF apuntan que en el año 2006 en el 64% de los casos de FIV se introdujeron dos embriones por ciclo.
Pero, y aquí está el problema, ¿cómo saber cuáles son los mejores? La embrióloga Montse Boada, directora del laboratorio de reproducción asistida del USP Institut Universitari Dexeus, admite que en esta parcela se ha avanzado poco durante las últimas décadas: "Básicamente hemos mejorado en experiencia y en la microscopía".
Para elegir a los embriones más sanos que se implantarán en la madre, los especialistas se guían por cuatro parámetros, todos ellos relacionados con el aspecto externo del embrión bajo el microscopio.
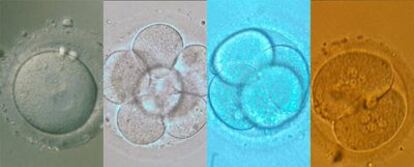
Uno de ellos se refiere al ritmo de división. El primer día, el cigoto, aún sin dividir, debe tener dos pronúcleos. El segundo, el embrión debe tener cuatro células -llamadas blastómeros- y el tercero ocho (véanse fotografías superiores). Si va retrasado en este proceso de multiplicación celular, el pronóstico de implantación no es satisfactorio. Tampoco será bueno si presenta células con formas irregulares y asimétricas, si se observan fragmentos del citoplasma o si las células tienen más de un núcleo. Son criterios morfológicos que, en el fondo, en algunos casos no dejan de ser intuitivos y subjetivos. Por ello, los embriones seleccionados no siempre cumplen las expectativas. Incluso algunos con mal pronóstico consiguen anidar en el útero y desarrollarse, de igual forma que sucede lo contrario.
Esta selección, la basada en la morfología, es el procedimiento que se emplea en el 80% de los casos, cuando no hay factores de riesgo. En el 20% restante, el estudio de viabilidad embrionaria se lleva a cabo mediante procedimientos invasivos, lo que también presenta inconvenientes.
Cuando el óvulo fecundado tiene tres días y presenta un aspecto similar a una mora de ocho células, se extrae una de ellas para analizarla y determinar, a partir de los resultados obtenidos, la salud embrionaria. Pero se trata de un proceso en el que una mano poco experimentada podría lesionar el embrión. "De esta forma, la ventaja de eliminar la anormalidad se contrarrestaría con la transferencia de un embrión dañado", apunta Antonio Pellicer, codirector del IVI.
Pero, además, hay otro inconveniente. Existe la posibilidad de que el blastómero seleccionado sea el único que presenta alteraciones, lo que llevaría a desechar a un embrión perfectamente sano. O el caso contrario, lo que también llevaría a un diagnóstico equivocado. Además, una biopsia es cara, hasta el punto de llegar a duplicar el precio del proceso y situarlo en torno a los 2.000 euros.
Por ello, los esfuerzos se dirigen hacia poder determinar la salud y la capacidad de implantación de los embriones sin llegar a tocarlos. Hasta el momento, la opción en la que están puestas las principales esperanzas para conseguir alcanzar esta meta es la del análisis del metabolismo del óvulo fecundado. El objetivo consistiría en "ser capaces de saber lo que un embrión consume y expulsa en el medio de cultivo donde se desarrolla los primeros días de su existencia", como apunta el codirector del IVI. Una vez procesada esta información, que se obtendría de una simple gota del medio de cultivo, se podría determinar cuáles son los valores que indican qué embrión está fuerte y sano, y cuáles no llegarán a crecer en el útero.
Pellicer lo compara con un análisis convencional. "Al saber los parámetros sanguíneos de un paciente (el colesterol, azúcar, tensión...) y sus hábitos de consumo (comidas, tabaco, alcohol) podemos hacernos una idea de si está sano o no". Y los primeros resultados apuntan a que estos estudios pueden aportar información muy valiosa. "Por un lado resolveríamos los problemas de las biopsias, pero si además resulta tan específica para eliminar las anomalías cromosómicas causantes del síndrome de Down o de Turner como nuestros datos iniciales sugieren, estamos ante una técnica de aplicación necesaria en un futuro inmediato".
De momento, no hay consenso en los metabolitos -las sustancias resultantes de los procesos de regulación celular, como el glutamato, el lactato o la alanina- a los que hay que prestar atención para evaluar la capacidad de implantación que tendrá el embrión.
La empresa estadounidense Molecular Biometrics está metida de lleno en esta tarea. De hecho, tiene en marcha varios ensayos clínicos, en algunos de los cuales participan tanto la Dexeus como algunas clínicas del IVI. "El objetivo debería ser encontrar entre 15 y 20 metabolitos que fueran determinantes en la implantación", apunta Carlos Simón, responsable de la fundación de investigación del IVI. Aunque parece que la meta no está a la vuelta de la esquina. "Es un campo muy esperanzador, pero aún está todo bastante verde", indica Montse Boada.
Junto a esta firma existe otra empresa española que apuesta firmemente por este camino. Se trata de Embryomics, una compañía creada el verano pasado, participada por el IVI y que se dedica en exclusiva al diagnóstico de embriones basado en la metabolómica. "Estamos muy cerca de identificar embriones con alteraciones cromosómicas empezando por el síndrome de Down", apunta Simón. El análisis de esta alteración es el primer objetivo que se ha marcado esta nueva empresa.
Existen otros caminos que tratan de diagnosticar la calidad de los embriones de formas no invasivas. Uno de ellos es la proteómica, que consiste en llegar a las mismas conclusiones a partir de estudiar en el caldo de cultivo las enzimas del embrión, lo que da indicios de sus características genéticas. También ha habido acercamientos mediante el análisis del consumo de oxígeno embrionario. Incluso se han elaborado sistemas matemáticos. Un grupo de investigadores del Intelligent System Groups, de la Universidad del País Vasco, dirigido por Dinora Morales, ha diseñado un método, a través de un sistema de probabilidades, en el que a partir de determinados datos clínicos de la pareja (edad, calidad del esperma) y de características morfológicas del cigoto, arroja como resultado una cifra de probabilidad de implantación. Ninguno de ellos ha ofrecido resultados que resulten satisfactorios para las clínicas de fertilidad.
Especialistas como Carlos Simón consideran que, si en condiciones ideales el éxito de los tratamientos puede alcanzar el 60% de los casos, los avances en la selección de embriones pueden aportar otros 30 puntos porcentuales.
La otra cara de la moneda en la fecundación está en la receptividad endometrial de la madre, factor al que correspondería el 10% restante. Pero esto ya es otra historia.
Pese a la resistencia de los sectores más clásicos, que siguen confiando en la biopsia y los estudios genéticos, buena parte de los embriólogos apuestan por la metabolómica como la alternativa de futuro para acabar con los embarazos múltiples. Una idea que se resume en el lema Un embrión, un bebé.
Una elección, dos elecciones, tres elecciones
En los tratamientos de fecundación in vitro, el cribaje que se practica para elegir a los mejores embriones tiene un único condicionante. Se trata de seleccionar, a través del microscopio, a los aparentemente más fuertes, más maduros y con más posibilidades de anidar en el útero de su madre.
Ésta es la característica primordial que se le exige a los embriones concebidos en el laboratorio. Pero los requisitos se pueden complicar bastante más. La legislación española permite elegir, entre estos embriones sanos, aquellos que no hayan heredado las alteraciones genéticas de sus padres para cortar con la transmisión de la enfermedad que padecen.
La Ley de Reproducción Humana Asistida de 2006 ampara esta forma de selección genética (que no manipulación) si se trata de una enfermedad hereditaria grave, precoz y sin tratamiento. En estos requisitos encajan, por ejemplo, la fibrosis quística, la hemofilia, el síndrome de X frágil o la enfermedad de Huntington.
Para conseguirlo, se recurre al llamado diagnóstico genético preimplantacional, que consiste en obtener una célula del embrión cuando tiene tres días para analizarla y buscar la alteración genética. Así, solo se implantarán en la madre los embriones que no hayan heredado la anomalía.
En abril, la Comisión Nacional de Reproducción Asistida dio un paso más e incluyó en la lista de patologías a la predisposición de desarrollar un tumor, lo que representa un salto cualitativo respecto a las anteriores condiciones. Ya no se trataba de esquivar un gen que va a causar al 100% de seguridad una enfermedad, sino una alta probabilidad de desarrollarla.
En estos casos, el descarte es doble: se eligen los embriones fuertes y sin alteración genética. Pero la ley también permite una vuelta de tuerca más cuando el objetivo es que los progenitores tengan un bebé que pueda salvar la vida de un hermano. Entonces se daría una triple selección.
A los dos requisitos anteriores (fortaleza, sin enfermedad genética) se suma otra condición: los embriones deben de compartir unos factores de histocompatibilidad con su hermano. De esta forma, la sangre del cordón umbilical del recién nacido podrá servirle en un futuro trasplante de médula para curar la enfermedad intratable que padece.
A la Iglesia católica, los procedimientos de selección genética de embriones le parecen técnicas eugenésicas ya que eliminan a los enfermos y dejan vivir a los sanos. Pero tampoco acepta una simple fecundación in vitro. Infringen la barrera que tutela la dignidad humana, en palabras de Benedicto XVI.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.




























































