Europa planea acelerar la vacuna del H1N1 contra el parecer de la OMS
La vía de urgencia implica suprimir ensayos - Los expertos alertan del riesgo de comprometer la seguridad y eficacia del fármaco

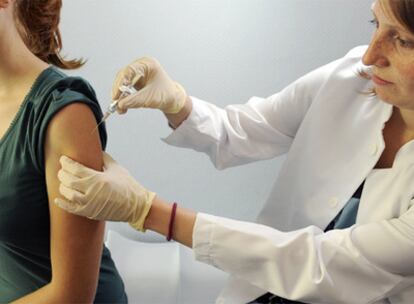
La vacuna contra la nueva gripe se ha convertido en una de las inmunizaciones más codiciadas. Todos la quieren. La amenaza de la llegada del invierno al hemisferio Norte, y con ella de un pico en los contagios por el virus H1N1, preocupa a la población y a los gobiernos. Tanto que la Agencia Europea del Medicamento (EMEA) se está planteando aprobar este fármaco por el procedimiento de emergencia. Esto supondría acortar el plazo de los ensayos o incluso suprimir algunos. La Organización Mundial de la Salud (OMS) ya ha advertido del riesgo de acelerar el proceso. No es la única. Los expertos también están preocupados. Podría hacer pasar por alto, dicen, aspectos relevantes de seguridad y eficacia.
"Primero es la seguridad y luego la efectividad, dice un experto"
Francia quiere vacunar al 70% de la pobalción. España, al 40%
Varios laboratorios ultiman su vacuna. Algunos ya están listos para comenzar -o incluso ya han comenzado- sus ensayos clínicos. Con éstos inconclusos o reducidos al máximo, explican fuentes sanitarias, la inmunización estaría lista en septiembre. La EMEA podría aprobar el fármaco sólo con la información previa disponible -ya que algunos medicamentos están basados en una vacuna para la gripe aviar que ya fue aprobada- y luego controlar si hay algún motivo de riesgo con el sistema de farmacovigilancia. Es decir, con los casos de efectos secundarios que se reporten. Así, si se pisa el acelerador, la vacuna podría inocularse a la población a finales de septiembre. Si no, dicen los expertos, habrá que esperar a noviembre o diciembre.
"Todo el mundo relacionado con el trabajo de la vacuna, desde los laboratorios hasta las agencias reguladoras, está pensando en qué pasos se pueden dar para hacer el proceso lo más rápido posible", explicó Keiji Fukuda, subdirector general de la OMS, en una entrevista a Associated Press. Sin embargo, recalcó: "Una de las cosas que no se puede comprometer es la seguridad de las vacunas. Hay áreas en las que quizá se puede ahorrar tiempo, pero hay otras en las que no puedes aplicar ninguna medida de ese tipo".
La aprobación por la vía de emergencia supone, cuando menos, que se va a suprimir alguna parte de los ensayos. "Por ejemplo la fase cuatro, la que se hace en grupos especiales", explica Juan Martínez Hernández, especialista en Medicina Preventiva y miembro de la Comisión de Salud Pública de la Organización Médica Colegial (OMC). Martínez Hernández cree que, tal y como están las cosas, no está justificado correr tanto. A pesar de que hay más de 162.380 afectados por la gripe A en 168 países, según los últimos datos de la OMS, la mayoría tienen síntomas leves. La pandemia ha causado 1.154 muertos.
"La historia nos ha enseñado casos en los que se actuó de manera precipitada y los resultados fueron contraproducentes, porque todo se hizo de forma acelerada y el pánico y la política guiaron unas decisiones equivocadas", cuenta José María Martín Moreno, catedrático de Medicina Preventiva y Salud Pública y asesor de la OMS.
Ambos expertos recuerdan un antecedente similar en Estados Unidos. Allí, entre octubre de 1976 y enero de 1977, 40 millones de ciudadanos fueron vacunados contra una gripe porcina que estaba generando gran alarma. La vacuna se aprobó de manera acelerada y, al final, se produjeron efectos adversos. Entre ellos, el síndrome de Gillain-Barré, un trastorno que produce debilidad muscular y parálisis flácida. Muchas víctimas recibieron indemnizaciones del Gobierno. Un caso que no tiene por qué repetirse -la producción y los fármacos están hoy mucho más avanzados y son más seguros-, pero que se debería tener en cuenta, dicen.
En Europa, algunos países planean vacunaciones masivas. Grecia quiere inocular el fármaco a todos sus ciudadanos, Francia ha comprado ya inmunizaciones para el 70% de su población, Reino Unido para el 50% y España para el 40%. La mayoría afirma que comenzará a vacunar a sus grupos de riesgo tan pronto como el fármaco esté aprobado. Todos hablan de la posibilidad de acortar los ensayos. Tienen muy presente el pronóstico del Centro Europeo para la Prevención y el Control de las Enfermedades (ECDC), que prevé que el 30% de la población se infectará. Una cifra ratificada ahora también por la OMS. Sin embargo, serán las autoridades de la EMEA quienes decidan si pisan el acelerador. Y también dentro de la propia agencia, aseguran fuentes sanitarias, hay discrepancias. Probablemente la EMEA esperará hasta septiembre para tomar una decisión, tras observar el comportamiento del virus en los países más fríos de Europa.
"Es un debate técnico más que gubernamental. España es partidaria de que se haga un análisis con el máximo rigor científico", sostiene el secretario general de Sanidad, José Martínez Olmos, quien considera que las recomendaciones de la OMS deben ser tenidas muy en cuenta. "Si plantea que conviene ultimar todos los ensayos clínicos es porque no tiene justificación adelantar la vacuna", dice. Y explica que la EMEA tiene "grandes técnicos" para tomar la decisión.
"Hemos de asegurarnos que el beneficio obtenido sea objetivamente superior al riesgo de presentar una reacción adversa asociada a su administración", dice José María Martín Moreno. También Juan Martínez Hernández: "Primero es la seguridad y luego la efectividad, incluso en la pandemia. Además, aunque no esté lista para el inicio del pico de casos, lo estará luego para todo el año".
Pero el dilema de los plazos no sólo existe en Europa. También EE UU quiere la vacuna ya. Hace unos días la revista The Lancet advertía en su editorial del riesgo de que se opte por una producción rápida de la inmunización desoyendo la recomendación de la OMS acerca de que el fármaco debe formularse con adyuvantes de aceite en agua y virus vivos atenuados. Esto permitiría tener más dosis y más eficaces contra variantes del virus.
Los expertos, además, recuerdan que la vacuna no será la solución a todos los males. "No es la panacea. Todos los años muere gente por la gripe común a pesar de que existe inmunización", dice Andreu Segura, especialista en Inmunología y Salud Pública y miembro del Comité Científico que asesora al Gobierno sobre la gripe A. Lo más importante, dice Martínez Olmos, es tener en cuenta las medidas de higiene y prevención que recomiendan las autoridades. Y agrega: "La vacuna es una opción que puede ser importante cuando se tenga, pero la prevención es fundamental".
Diario de la crisis
- La nueva gripe ha causado ya 1.154 muertos y ha afectado a 162.380 personas en 168 países, según los últimos datos de la OMS. El continente americano y, después, el asiático son las zonas más afectadas.
- La octava fallecida por el virus H1N1 en España, una mujer de 35 años, "acudió tarde" al hospital, según la consejera de Sanidad de Cataluña, Marina Geli.
- La Comunidad Valenciana ha creado una web en la que los ciudadanos que sospechen que tienen gripe A pueden autoevaluarse con un cuestionario.
- En Brasil, un juez ordenó a los seguidores que asistan a un partido de fútbol en Río de Janeiro que usen mascarillas para protegerse de un posible contagio de H1N1. Ese país ha registrado 129 muertes por la enfermedad.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.
Sobre la firma

Archivado En
- Legislación sanitaria
- Gripe A
- OMS
- Agencia Europea Medicamento
- Enfermedades respiratorias
- Adjudicación contratos
- Prevención enfermedades
- Vacunas
- Víctimas
- Estados Unidos
- Contratos administrativos
- Vacunación
- Salud pública
- Derecho administrativo
- ONU
- Sucesos
- Medicina preventiva
- Política sanitaria
- Enfermedades
- Organizaciones internacionales
- Sanidad
- Medicina
- Relaciones exteriores
- España
- Administración pública