Las autoridades de México aprueban dos medicamentos con anticuerpos para tratar la covid-19
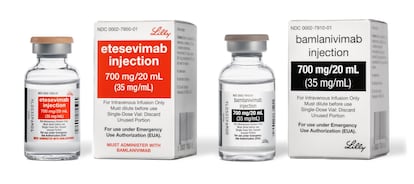
El uso combinado de Bamlanivimab y Etesevimab, dos sustancias inyectables, ayuda a atender síntomas leves y moderados, aunque en EE UU se ha puesto en duda su eficacia ante las variantes del virus

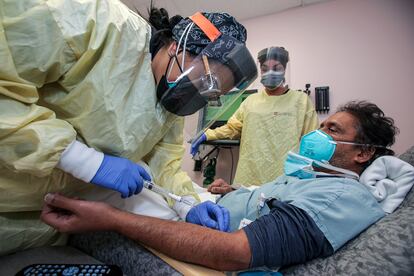
Las autoridades sanitarias de México han dado luz verde a la aplicación de dos nuevos fármacos para el tratamiento de la covid-19. La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) ha emitido una autorización de uso de emergencia para Bamlanivimab y Etesevimab, dos sustancias inyectables que cuando son utilizadas de forma combinada han sido efectivas para atender síntomas leves y moderados en enfermos por coronavirus, tanto en adultos como en pacientes pediátricos mayores de 12 años. Estados Unidos aprobó su uso desde septiembre pasado, pero los reguladores estadounidenses han limitado su distribución en zonas del país con una alta prevalencia de variantes como delta y gamma, que han mostrado una “susceptibilidad in vitro reducida ante estos agentes”.
Las primeras noticias de Bamlanivimab llegaron el año pasado y se presentó como el primer medicamento desarrollado contra la covid. Es una terapia basada en anticuerpos monoclonales, que son un tipo de proteínas artificiales creadas para ayudar al sistema inmune a identificar y atacar “organismos extraños”, como virus o bacterias. La ventaja de los anticuerpos monoclonales, comunes en los tratamientos contra el cáncer, es que pueden neutralizar patógenos específicos, en este caso, bloquean la proteína espiga del coronavirus, explica Carlos Rius, profesor de la facultad de Química de la Universidad Nacional Autónoma de México. Etesevimab también es un tratamiento basado en anticuerpos. Ambos fueron creados por la farmacéutica estadounidense Eli Lilly. Los anticuerpos monoclonales, por ejemplo, fueron parte del cóctel de medicamentos experimentales que recibió Donald Trump cuando se enfermó de covid, de acuerdo con la revista Science.
Ambos medicamentos funcionan en combo, es decir, se administran juntos. “La combinación ha mostrado que reduce el riesgo de hospitalización y de muertes en pacientes con síntomas leves y moderados de covid-19 y ciertos factores de riesgo por la progresión de la enfermedad”, señala el Instituto Nacional de Salud de EE UU. Los medicamentos se aplican de forma intravenosa durante un tiempo, entre 20 minutos y algo más de una hora. Se recomienda, sin embargo, recibir las inyecciones poco después de tener un diagnóstico positivo del virus o si se ha estado en contacto con otras personas contagiadas porque no está aprobado para pacientes hospitalizados o que ya estén en fases avanzadas de la enfermedad. “Funciona antes de que empiece a actuar el virus fuertemente en el cuerpo”, explica Rius, “nos da una ventana de acción muy pequeña”.
La Cofepris ha destacado que este tratamiento ha mostrado “resultados positivos de prueba de diagnóstico directo del virus SARS-CoV-2, y que presentan comorbilidades de muy alto riesgo que no estén controladas”. En línea con los reguladores estadounidenses, las autoridades mexicanas han enfatizado que los tratamientos contra la covid-19 no son sustitutos de las vacunas. “La autorización para uso de emergencia es provisional, en apoyo a las acciones de atención para la pandemia”, ha insistido la agencia mexicana.
Los efectos secundarios reportados por la propia farmacéutica en la fase experimental son reacciones alérgicas como fiebre, escalofríos, náuseas, dolor de cabeza, dificultad para respirar y cambios súbitos en la presión arterial. También es posible que, tras recibir el fármaco, el paciente experimente síntomas nuevos o más fuertes de la covid-19 como fiebre, dificultad para respirar, cansancio, debilidad y cambios en el ritmo cardíaco. “Esta autorización para uso de emergencia se emite después de una evaluación por parte de personal dictaminador especializado de Cofepris, que se enfoca en el cumplimiento de los requisitos necesarios para garantizar calidad, seguridad y eficacia en los componentes”, ha señalado la Cofepris.
El precio de Bamlanivimab es de 1.250 dólares por vial de 700 miligramos, según lo que informó Eli Lilly tras firmar un acuerdo con el Gobierno estadounidense para proveer 300.000 viales. Rius dice que uno de los puntos más importantes es el costo. “En el caso de estos compuestos se habla de 50.000 pesos por dosis”, señala el académico. “Afortunadamente, se habla de que se necesitan una o dos dosis”, agrega. Rius comenta que “funciona por un tiempo, pero no demasiado, depende de cómo mute el virus”.
El camino de ambos medicamentos ha sido complicado en Estados Unidos por el surgimiento de las variantes. Bamlanivimab, sin combinarse con Etesevimab, había sido aprobado para su uso de emergencia en noviembre del año pasado, pero se retiró la autorización provisional en abril. “Basado en un análisis continuo de nuevos datos científicos, específicamente el aumento sostenido de variantes del SARS-CoV-2 resistentes al Bamlanivimab y que ha resultado en un incremento del riesgo de que fracase el tratamiento, la FDA ha determinado que los beneficios potenciales y conocidos ya no superan los riesgos potenciales y conocidos para su uso autorizado”, se lee en un comunicado de los reguladores estadounidenses.
“Los tratamientos con anticuerpos monoclonales son terrenos un poco desconocidos”, apunta Rius, quien dice que aún se investiga la efectividad de estas terapias contra la covid. “Son herramientas que estamos encontrando, pero todavía no tenemos ninguna solución mágica para resolver el problema”, matiza.
Para agosto, las autoridades sanitarias de Estados Unidos dieron una prórroga de entre 12 y 18 meses para que el Bamlanivimab y Etesevimab permanecieran en los anaqueles, siempre y cuando se apliquen juntos. También se condicionó su distribución a la presencia de esas llamadas “variables resistentes” a esos medicamentos. En septiembre, los laboratorios que estaban impulsando investigaciones con anticuerpos monoclonales se enfrentaron a regulaciones adicionales del Gobierno estadounidense, ante un aumento súbito de la demanda de suministros para ese tipo de tratamientos tras la expansión de delta en el país. Ante el surgimiento de ómicron y las preocupaciones de la Administración de Joe Biden, Eli Lilly ha dicho que ya acelera las investigaciones para robustecer sus tratamientos ante las características de la nueva variante, aunque todavía no ha publicado datos de efectividad.
Suscríbase aquí a la newsletter de EL PAÍS México y reciba todas las claves informativas de la actualidad de este país
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.








































