Este ovario artificial nace, crece y reproduce
El desarrollo de órganos de recambio diseñados con células del propio paciente abre puertas a la esperanza - La recreación de la función ovárica es el último paso - Lo más ambicioso: crear un corazón
En el fondo, la explicación más simple de la medicina regenerativa sería compararla con lo que hace el mecánico en un taller de reparaciones. De forma similar a cómo se cambia la inyección o la transmisión del coche cuando se han averiado, el objetivo final de esta disciplina es poder crear algún día en el laboratorio órganos artificiales biológicos (nada de prótesis autónomas) a partir de células del paciente, para sustituir un corazón, un riñón o una tráquea que no funcionan adecuadamente. Y en este proceso, las células madre, con su extraordinaria capacidad de proliferación y de especializarse en los distintos linajes celulares, son las protagonistas absolutas.
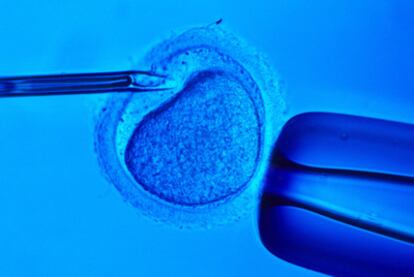
Uno de los últimos pasos en esta carrera ha llegado de la Universidad de Brown y del Women and Infants Hospital of Rhode Island, en Estados Unidos. Un equipo de investigadores ha logrado recrear in vitro un ovario artificial que ha conseguido en el laboratorio madurar ovocitos de forma que puedan ser fecundados e implantados, ya como embriones, en el útero de la madre. El objetivo es poder llegar a suplir la función ovárica en mujeres que, por ejemplo, tras un tratamiento de quimioterapia o radioterapia, la hubieran perdido.
Harán falta décadas para que la sustitución de órganos sea eficaz
Un trabajo con conejos consiguió no solo erecciones sino procreación
En Valencia pretenden crear espermatozoides en un medio artificial
Hay un trabajo de éxito con la implantación de vejigas en niños
Se podrían analizar los contaminantes en la maduración de los óvulos
El proyecto más espectacular en España es el diseño de un corazón
Esta línea de trabajo está cada vez más extendida en la medicina regenerativa. Equipos inspirados en la misma filosofía están tratando de recrear un corazón a través de la regeneración de un órgano desechado para trasplante con células madre, como el dirigido por el jefe de servicio del hospital Gregorio Marañón, Francisco Fernández-Avilés. En Valencia, un grupo del Centro de Investigación Príncipe Felipe pretende poder reproducir testículos artificiales biológicos.
No siempre la finalidad consiste en crear un nuevo órgano de recambio, como en el caso del corazón. En ocasiones, si se trata de órganos no vitales, como el ovario, basta con reproducir su función en el laboratorio. Esto es lo que ha conseguido el equipo estadounidense dirigido por la investigadora Sandra Carson.
Hasta el momento, la práctica más parecida para preservar la fertilidad en las mujeres es el reimplante de tejido ovárico. Buena parte de las personas que se someten a esta operación son pacientes a las que se les ha detectado un tumor.
Las sesiones de quimioterapia y radioterapia, en función de la intensidad del tratamiento, el tipo de cáncer o la lesión del paciente, pueden debilitar gravemente su capacidad reproductora. Antes de que esto suceda, las mujeres tienen la posibilidad de salvaguardar parte de su tejido ovárico, de forma que después del tratamiento, se le pueda reimplantar y puedan volver a ovular. El proceso consiste en extraer por laparoscopia la corteza de un óvulo -que contiene decenas de miles de ovocitos inmaduros- y congelarla. Cuando la paciente se encuentra recuperada del cáncer y desea ser madre, se le reimplanta el tejido en el otro óvulo, que al no haber sido manipulado ha estado menos expuesto a la medicación o a la radiación y se encuentra en un mejor estado. En varios meses, si todo ha ido bien, la mujer recupera su función ovárica.
Es una técnica reciente. En 2004 nació en Bélgica el primer bebé concebido tras este procedimiento experimental. En España, el primer caso tuvo lugar el mes de agosto del año pasado en el hospital Doctor Peset de Valencia. Pero el proceso presenta inconvenientes. Por un lado, el ovario solo vuelve a trabajar durante una temporada. Hasta el momento, se ha conseguido devolver la capacidad de volver a producir ovocitos en unos dos años.
Tampoco sirve para todo tipo de tumores, como las leucemias. Pero, sobre todo, no hay certeza absoluta de que al reimplantar el tejido obtenido no existan células malignas que puedan reactivarse en el cuerpo de la mujer.
Por eso, uno de los aspectos más destacados de la técnica publicada por el equipo de Sandra Carson en el Journal of Assisted Reproduction and Genetics el 25 de agosto es que evitaría de raíz este riesgo, como destaca el jefe de servicio de ginecología del hospital La Fe de Valencia, Antonio Pellicer. "Éste es el aspecto más interesante del trabajo", comenta.
Los científicos de la Universidad de Brown crearon un molde a partir de un gel (un polisacárido denominado agarosa) para usarlo como base del cultivo tridimensional sobre el que trabajaron. Sobre esta matriz recrearon el funcionamiento del ovario en el laboratorio al combinar los tres principales tipos de células del ovario.
Para que un ovocito (primer tipo celular) madure debe estar recubierto de una capa de células de la granulosa (segundo tipo) y esta, a su vez, de células de la teca (tercer tipo). Los investigadores reprodujeron este esquema. Diseñaron una estructura en forma de panal de abeja con células de la teca obtenidas de donantes y la situaron sobre el gel. Sobre esta trama encajaron cogollos de ovocitos inmaduros cubiertos de células de la granulosa también donados. A las 72 horas, las células de la teca habían envuelto totalmente los cogollos. Extrajeron los ovocitos y los investigadores observaron que habían madurado. "Es el primer éxito en el uso de ingeniería de tejidos en tres dimensiones en la maduración in vitro de ovocitos", defienden los autores de la publicación.
Quizás no sea para tanto. La revista Journal of Assisted Reproduction and Genetics tiene un índice de impacto (la forma de medir la importancia de una publicación científica) de 1,3, muy bajo en medicina reproductiva. Pero si la técnica llega a estandarizarse podría sustituir al trasplante de tejido ovárico (y evitar los problemas que lleva aparejados). Además, se podría emplear este ovario artificial de "laboratorio viviente", como lo define la propia Sandra Carson. No solo a la hora de estudiar cómo funciona un ovario sano, sino también para analizar los efectos de, por ejemplo, contaminantes en la maduración de los óvulos.
Este trabajo es una muestra más de las expectativas que abre la recreación en laboratorio de órganos biológicos de sustitución en cada vez más especialidades médicas. Uno de los grandes especialistas en la materia es Anthony Atala, director del Instituto de Medicina Regenerativa de la Universidad de Wake Forest, en Carolina del Norte. Entre los principales éxitos de esta medicina regenerativa basada en la ingeniería de tejidos se encuentra el diseño e implantación en chicos de siete a 19 años de vejigas creadas en laboratorio, que se anunció en 2006. En este caso, los órganos se crearon con las propias células de los pacientes sobre un molde biodegradable y ofrecieron buenos resultados funcionales, durante más de cinco años.
El equipo de Atala trabaja en aplicar esta técnica contra la impotencia humana. El año pasado presentó un trabajo en el que consiguió que conejos con lesiones en el pene volvieran a tener erecciones después de crear tejido cavernoso en el laboratorio y trasplantarlo a los animales. Recuperaron la función sexual y lograron reproducirse.
Con la vista puesta no en el pene, sino en los testículos, trabaja un equipo del Centro de Investigación Príncipe Felipe de Valencia. Uno de sus científicos se ha desplazado al laboratorio de Atala con la intención de crear un testículo biológico artificial. La idea de estos investigadores es estudiar la generación de espermatozoides a partir de sus células progenitoras, las espermatogonias. Y tratar de reproducir este proceso natural en un medio creado artificialmente.
Aunque quizás el proyecto más espectacular (y experimental) que se lleva a cabo en España es el diseño en laboratorio de un corazón que pudiera servir para autotrasplantarlo al paciente con dolencias cardíacas. En este proyecto participa tanto la Organización Nacional de Trasplantes, como la Universidad de Minnesota (EE UU) y el hospital Gregorio Marañón de Madrid.
En este caso, el molde no se obtiene de ninguna sustancia biodegradable, sino de otro corazón desechado para trasplante. A través de un baño de enzimas, se despoja al órgano de todas las células que conforman sus paredes, las que recubren el interior de los vasos y las válvulas hasta dejarlo en su estructura interna más básica, que no es más que una matriz. Sobre este molde se siembran células madre cardiacas para que proliferen y reproduzcan la estructura del corazón, de forma que pudiera servir para ser trasplantado.
"De momento tenemos ya bastantes matrices y estamos empezando a recelularizar partes de las piezas", comenta Francisco Fernández-Avilés, jefe de cardiología del hospital madrileño. "En el mejor de los casos, habrá que esperar 10 años para aplicar la técnica".
Existe un referente de éxito de este ensayo en España, aunque con un órgano bastante menos complejo. Se trata del trasplante de tráquea que se llevó a cabo en el hospital Clínic de Barcelona en 2008. El proceso también consistió en centrifugar la tráquea del donante a la que se le eliminaron las células capaces de despertar una reacción de rechazo en el receptor. La estructura tubular resultante se recubrió de células madre del paciente y la nueva tráquea se transfirió con buenos resultados.
Hará falta que pasen varias décadas hasta que la sustitución, pieza a pieza, de órganos complejos bioartificiales demuestre su eficacia y, quién sabe, forme parte de la cartera de servicios de la sanidad española. O de los talleres de la medicina del futuro.
Órganos creados en el laboratorio
- Vejigas. El equipo del investigador estadounidense Anthony Atala, del Instituto Wake Forest de Medicina Regenerativa, publicó en The Lancet en 2006 la implantación de siete vejigas artificiales creadas en laboratorio a partir de moldes biodegradables que fueron colonizados por cultivos celulares de los propios pacientes.
- Tejido cavernoso del pene. El mismo grupo de Wake Forest anunció el año pasado el trasplante de tejido cavernoso creado a partir de las células del receptor en conejos. La operación devolvió la función eréctil a los animales. El objetivo es combatir en el futuro la impotencia masculina mediante trasplantes similares.
- Corazón. Un equipo del que forma parte la Organización Nacional de Trasplantes, el hospital Gregorio Marañón y la Universidad de Minnesota trabaja en la creación de corazones bioartificiales. Después de haber conseguido distintos moldes a partir de corazones no válidos para trasplante, están ensayando la colonización con células madre cardiacas de estas matrices. En el futuro se plantean abordar la misma técnica para crear hígados.
- Tráquea. El hospital Clínic de Barcelona implantó en una mujer una tráquea obtenida de donante y colonizada por sus propias células (epiteliales de la nariz y células madre de la cadera) para sustituir a la suya gravemente dañada por una tuberculosis.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.



















