Un laboratorio colombiano contra el tipo de cáncer de mama más letal en el mundo
Científicos de la Universidad Nacional han desarrollado una vacuna 100% personalizada a partir de los tumores de cada paciente. El tratamiento está en ensayo clínico fase 1 y se ha aplicado a cinco mujeres

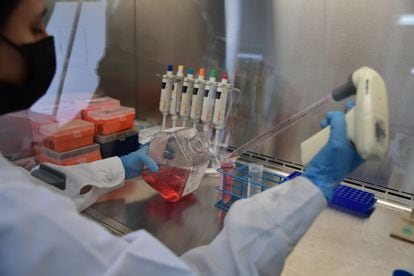
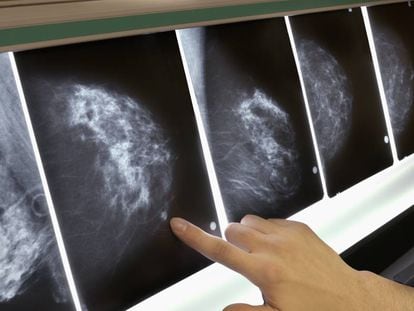
El profesor Carlos Alberto Parra López es el líder de un equipo de científicos colombianos que desde hace 12 años trabaja en la búsqueda de un tratamiento efectivo contra el tipo de cáncer de seno más letal en el mundo: el cáncer de mama triple negativo. El doctor Parra y sus compañeros del Grupo de Investigación en Inmunología y Medicina Traslacional de la Universidad Nacional, en Bogotá, han creado una vacuna a partir de los tejidos tumorales de cada paciente. “Las vacunas que estamos haciendo para la inmunoterapia son 100% personalizadas”, explica Parra. El novedoso tratamiento, que en el futuro cercano puede ser una alternativa real para mejorar la calidad de vida de los enfermos y evitar las fuertes recaídas, está siendo aplicado a cinco mujeres con diagnósticos graves. La comunidad médica aguarda con esperanza los resultados del ensayo clínico.
Las vacunas personalizadas elaboradas con los tumores para combatir el cáncer son hoy en día uno de los tratamientos más prometedores en la lucha contra esta enfermedad. Desde hace aproximadamente diez años, distintos grupos de investigación en todo el mundo trabajan en su desarrollo. Pedro Romero López, director del Instituto Ludwig para la Investigación del Cáncer, en Lausana, Suiza, explica que generar vacunas eficaces es uno de los desafíos más importantes en la lucha contra el cáncer. “Se espera mucho de estos tratamientos de inmunoterapia”, explica por teléfono. Sin embargo, hasta ahora solo la vacuna contra cáncer de próstata metastásico, desarrollada por la farmacéutica Dendreon, ha sido aprobada por la FDA. Las demás, incluida la del cáncer de mama triple negativo elaborada en Colombia, siguen en fase clínica.

El letal cáncer de mama triple negativo
El cáncer de mama es el tipo de cáncer más común en el mundo, por encima del de pulmón y del melanoma, según la Organización Mundial de la Salud (OMS). Solo en 2020, se diagnosticaron 2.2 millones de casos nuevos de cáncer de seno y más de 685.000 mujeres murieron por esta causa en todo el planeta. Datos de la Asociación Española Contra el Cáncer revelan que una de cada ocho mujeres desarrollará cáncer de mama a lo largo de su vida. En Colombia, el Ministerio de Salud explica que esta es la primera causa de enfermedad y muerte por cáncer entre las mujeres del país. “Es un problema de salud pública. Es el cáncer más frecuente en Colombia, con 15.509 casos nuevos y 4.411 muertes en 2020″, se lee en un informe de la entidad.
En la actualidad, existen 24 grandes grupos de tumores de cáncer de mama, seis de ellos son triple negativo. A diferencia de la mayoría de los tumores, que responden relativamente bien a la cirugía, la quimioterapia o la radioterapia, los triple negativo no reaccionan de forma adecuada con los tratamientos convencionales. Parra, profesor titular de la Facultad de Medicina de la Universidad Nacional, doctor en Química y posdoctor en inmunología molecular y microbiología en Washington University, explica que el 15% del total de casos de cáncer de seno son de este tipo. “Son los más agresivos, los más difíciles de tratar, los de peor pronóstico”, dice, “por eso, la necesidad de estudiarlos y de desarrollar estas vacunas”.
De acuerdo con el profesor, muchos de los casos de pacientes con este cáncer recaen en los siguientes tres años, con una fuerza muy agresiva y mucha mortalidad. Médicos expertos del Instituto Clínico de Cleveland, en EE UU, coinciden en el diagnóstico: “el cáncer de mama triple negativo es la forma más agresiva y letal de cáncer de mama”. La principal razón de su complejidad es que este cáncer crece y se propaga en el cuerpo más rápido que los demás.
Susana Fiorentino Gómez, líder del grupo de Investigación en Inmunología y Biología Celular de la Universidad Javeriana en Colombia, explica por teléfono que el problema que tiene este cáncer es que su tratamiento es limitado y su pronóstico muy malo. “Después de terminar las terapias convencionales, las células desarrollan resistencia y aparecen metástasis tardías que son las que matan al paciente”, dice Fiorentino. Y añade: “tener una vacuna personalizada que despierte la respuesta inmune de los pacientes para protegerlos de la aparición de las metástasis es lo que se busca ahora en el mundo. Por eso, la aproximación del grupo de Parra es tan interesante”.
Vacunas 100% personalizadas
Para enfrentar al emperador de todos los males, como le llama al cáncer el oncólogo Siddhartha Mukherjee, galardonado con el premio Pulitzer por su biografía sobre esta enfermedad, Parra y sus colegas han desarrollado, por primera vez en Colombia, unas vacunas especializadas que se generan con dos componentes principales, ambos provenientes del cuerpo del paciente. El primer elemento son los antígenos obtenidos a partir del tumor. El segundo, las células dendríticas, que están en la sangre sana de cada persona. Por eso, cada vacuna es única y 100% personalizada.
El investigador Pedro Romero López explica que el proyecto del profesor Parra es muy prometedor por tres razones: por el tipo de cáncer al cual se dirige, por el tipo de objetivos que persigue y, sobre todo, por el abordaje experimental adoptado que según él está “al nivel de los centros de investigación contra el cáncer más adelantados en el mundo”. Para Romero, la ambición del grupo de buscar una vacuna personalizada es una empresa costosa y difícil de lograr en los países desarrollados, y mucho más en Colombia: “Yo diría que es un trabajo quijotesco, pero eso no quiere decir que no se deba hacer. Al contrario, resalta el coraje de estos investigadores”.
Laura Camila Martínez Enríquez, microbióloga, estudiante de Maestría en Inmunología y miembro del grupo de investigación del profesor Parra, cuenta desde el laboratorio que el primer paso para desarrollar la vacuna es extraer, preservar y estudiar el tumor de cada paciente. “Los tumores, más que un residuo biológico, son una verdadera caja de herramientas de la que se puede obtener mucha información para desarrollar nuevas alternativas terapéuticas”, explica Martínez. En el mismo tumor que generó la enfermedad está presente la cura. Solo hay que saberla buscar.
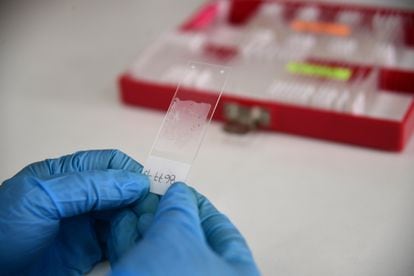
El segundo paso para el desarrollo de la vacuna es identificar los antígenos en el tumor que pueden servir para activar el sistema inmune. Se hace una secuencia genética de los cromosomas del tejido enfermo y se cruza esa información con el DNA de un tejido sano. El profesor Parra explica que en esta comparación se encuentra qué es lo normal y lo anormal en el tumor. “De esas diferencias surgen los antígenos que buscamos, que normalmente se conocen como mutaciones”.
En búsqueda de neoantígenos y células dendríticas
Una vez se organizan y se clasifican las mutaciones, un análisis bioinformático con inteligencia artificial, en el que participa un grupo interdisciplinario de ingenieros, biólogos, químicos y médicos, determina de forma aleatoria cuáles de ellas son reconocidas por las proteínas de la paciente y pueden despertar las respuestas del sistema inmunológico y atacar la enfermedad. “La cantidad de mutaciones no es un problema. Al contrario. Hay abundancia”, explica Parra. Normalmente, se identifican cientos de miles de mutaciones en un solo tumor, pero el desafío es escoger la mejor. La escogencia adecuada de esas mutaciones determina en gran medida el éxito de estas vacunas personalizadas.
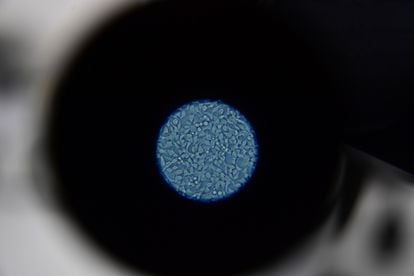
Cuando ya se han seleccionado las mutaciones más adecuadas, los científicos deben introducirlas en las células dendríticas, que fueron previamente extraídas de la paciente y funcionan como un vehículo para que los antígenos ayuden al sistema inmunológico a destruir las células cancerígenas. Para poder usar estas células dendríticas con ese propósito, el grupo de Investigación en Inmunología y Medicina Traslacional de la Universidad Nacional ha trabajado durante más de diez años con el fin de garantizar la seguridad y la eficacia clínica. “La mayoría de grupos de investigación en América Latina no utiliza estas células, sino que pone los antígenos en adyuvantes sintéticos. Esto, y nuestro trabajo con cáncer de mama triple negativo, nos diferencia de los demás”, explica Parra.
Después de que los antígenos seleccionados ya están dentro de las células dendríticas, el último paso es aplicar la vacuna a las pacientes en seis dosis durante algunos meses para ir evaluando el efecto en la destrucción del tumor cancerígeno. El profesor cuenta que las identidades de las cinco mujeres que ya recibieron las dosis son reservadas y que aún no se puede revelar los resultados preliminares del tratamiento. Sin embargo, es enfático en su optimismo: “Hay cierto consenso en el mundo científico que reconoce que estas vacunas funcionan en ensayos clínicos controlados y con pocas personas para atacar tumores como el melanoma o el cáncer de pulmón. Ahora hay que demostrarlo en el cáncer de mama triple negativo”, dice Parra. Y agrega: “Cuando se combinan las vacunas con otros tratamientos como anticuerpos, cirugías o quimioterapias, los resultados tienden a mejorar considerablemente”.
En el mundo hay varios ejemplos exitosos que respaldan la idea del profesor Parra. En 2017, la revista Nature publicó los resultados de dos estudios iniciales en humanos que muestran las posibilidades de crear vacunas para distintos tipos de cáncer. Un equipo de científicos del MIT y la Universidad de Harvard creó vacunas contra melanomas o cáncer de piel con hasta 20 neoantígenos diferentes asociados a las mutaciones de seis pacientes. Tras 25 meses de seguimiento, cuatro de los tratados no habían sufrido una recaída. El otro estudio fue el ensayo clínico de la empresa BioNTech en el que los científicos hicieron vacunas dirigidas a hasta diez mutaciones en 13 pacientes con melanoma y lograron que ocho permaneciesen libres de tumores hasta 23 meses después.

¿Cómo saber si la vacuna está funcionando?
María Alejandra Villota, Ingeniera Biomédica y Microbióloga del grupo del profesor Parra, explica que después de la aplicación de cada dosis de la vacuna se deben extraer ciertas células del cuerpo de las pacientes para estudiar sus comportamientos.
En el laboratorio hay una máquina llamada citómetro de flujo, que analiza célula por célula y permite identificar qué proteínas, qué tamaño y qué complejidad tiene cada una. El aparato, que funciona con un sistema de rayos láser, está conectado al computador y a un software especial que muestra cómo están las células antes y después de las dosis de la vacuna. “Podemos analizar si el sistema inmune está respondiendo al tratamiento”.
En específico, los investigadores se enfocan en la reacción de los linfocitos T, un tipo de célula que hace parte del sistema inmunitario y ayuda a proteger el cuerpo de las infecciones y a combatir el cáncer. Ante la pregunta de si se han alegrado mientras revisaban las células de alguna paciente en el citómetro de flujo, las investigadoras Laura Martínez y Alejandra Villota responden que sí con contundencia. “Estos son datos crudos, preliminares, después debemos analizarlos con otros programas más avanzados, pero aquí se empiezan a ver tendencias. Es una buena noticia cuando vemos que los linfocitos T se activan”, responde Martínez.

¿Altos costos y poca efectividad?
“El cáncer no es una sola enfermedad, sino muchas. Las llamamos ‘cáncer’ porque comparten una característica fundamental: el crecimiento anormal de las células”, dice Siddhartha Mukherjee en el libro El emperador del mal. Las razones de ese crecimiento dañino todavía son desconocidas, inciertas y difíciles de prevenir para la ciencia. Los tratamientos son costosos y no siempre muy efectivos.
El profesor Parra reconoce que aún falta un camino largo para que estás vacunas personalizadas lleguen a los hospitales y se apliquen de forma cotidiana en la mayoría de los pacientes. “Aún no sabemos qué tan efectivas son. No hay una respuesta exacta porque solo hasta hace muy pocos años el mundo científico empezó a desarrollar estas vacunas. No hay evidencia suficiente, se han aplicado a muy pocas personas”, explica el investigador.
El investigador Romero López cree que el uso de células dedríticas es extremadamente costoso, no solo en dinero, sino en tiempo y trabajo. “Me parece que en la práctica no es viable usar este tipo de células para la elaboración de las vacunas. Encontrarlas es difícil, su frecuencia en la sangre es extremedamente baja, por debajo de una en 10.000, son dificil de purificar, de mantener en forma y de expandirlas en numeros suficientes para volverlas a reinfusionar en el paciente”. dice Romero. Y concluye: “Si yo fuera el profesor Parra haría las vacunas con coadyudantes sintéticos”.
EL profesor parra reconoce que el diseño y la elaboración de estas vacunas es muy costoso. “Están hechas a la medida del tumor de cada paciente. Por eso no se ha podido masificar su producción”, explica. El trabajo de Parra y de sus compañeros de investigación es un pequeño avance en la lucha global contra una enfermedad que hoy en día sigue siendo la principal causa de muerte en el mundo, según la OMS.
*Esta nota fue posible gracias a una beca concedida por la Fundación Gabo y el Instituto Serrapilheira, con apoyo de Unesco.
Puedes seguir a MATERIA en Facebook, Twitter e Instagram, o apuntarte aquí para recibir nuestra newsletter semanal.
Sobre la firma

/cloudfront-eu-central-1.images.arcpublishing.com/prisa/5IGD42QIYVFOVOILVLBU2PG3ZY.jpg)